

在生物医学研究领域,类器官正凭借其独特优势改变着科研格局。作为由干细胞或多能干细胞经三维培养形成的微型组织模型,类器官能高度模拟体内器官的结构与功能,在疾病建模、精准医学、药物筛选及再生医学等领域展现出巨大应用潜力。比如肝细胞类器官为肝脏移植提供了新平台,呼吸道类器官还成功实现了人鼻病毒 C 的连续传代培养,解决了传统细胞系中难以培养该病毒的难题。
相较于传统 2D 细胞培养无法模拟组织微环境、动物模型存在物种差异及伦理限制的局限性,类器官在保留组织异质性、维持基因组稳定性方面优势较高,被视作替代传统模型的 “活体生物库”。但类器官技术的广泛应用,却受限于长期培养过程中的关键瓶颈 —— 传代操作。传代是维持类器官持续扩增与功能稳定的核心环节,其效率直接决定实验的可重复性与研究进展。
当前,像肝癌、甲状腺癌这类难养类器官,在传代过程中普遍面临活性不足、结构破坏等问题,有数据显示肝癌类器官传代后存活率不足 40%,导致这类模型难以用于长期实验研究。此外,传代过程中细胞存活率低、增殖效率差等问题,也制约着胰腺癌等疾病模型的研究进程,优化传代技术已迫在眉睫。
传代技术的核心挑战主要体现在三个方面:一是机械或酶解分离容易破坏类器官结构完整性;二是消化时间与力度控制不当会导致细胞活性下降;三是传代后基质包埋与培养条件适配性不足,影响后续增殖效率。这些问题在干细胞来源的复杂类器官(如肝 / 胰腺共祖细胞衍生模型)中更为突出,直接限制了其从基础研究向临床转化的应用。
基于此,深入分析类器官传代的关键技术节点,建立标准化操作流程,提供试剂盒选择的科学依据,探讨技术优化路径,对于解决难养类器官传代困境、推动类器官技术在精准医学与再生医学领域的规范化应用具有重要意义。
想要提升类器官传代效率,需精准把控消化、离心、基质胶处理等关键环节,具体技术要点如下:
• 消化体系:采用机械分散与酶解结合的方式,先通过 200μm 滤网过滤进行机械分散,再用 0.25% Trypsin-EDTA 在 37℃条件下孵育 5 分钟,实现类器官的有效分离。
• 离心条件:使用 4℃预冷的离心机,以 200×g 的转速离心 5 分钟,离心完成后弃去上清液,用培养基重悬沉淀,最大程度保留细胞活性。
• 基质胶处理:基质胶需在冰上融化,之后与细胞悬液按 1:3 的体积比混合,同时要确保每孔接种密度达到 5×10⁴个细胞,为类器官后续生长提供良好基础。
类器官传代技术的发展,见证了 3D 细胞培养从依赖经验到标准化、精准化的转变。早期传代操作高度依赖研究者经验,比如用手动刮除基质胶的物理分离方式,容易造成细胞机械损伤;酶消化时间仅靠肉眼判断,主观性强,常出现消化过度或不充分的情况,直接影响细胞存活率与类器官结构完整性。这种粗放式操作导致不同实验室、甚至同一实验室不同批次的传代结果差异明显,严重制约了类器官技术的可重复性与转化进程。
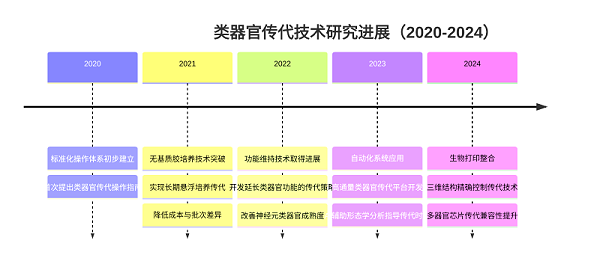
近五年,类器官传代技术在标准化与效率提升方面取得多项关键突破,形成了多维度的技术革新:
1. 标准化操作体系构建:消化酶与传代参数的优化是流程标准化的核心。TrypLE™系列等胰蛋白酶替代产品,凭借更温和的酶解特性,大幅降低了传统胰酶对细胞表面受体的破坏;传代比例控制(1:2-1:4)与机械分散技术结合,实现了肠道、肝等常规类器官的稳定传代。此外,食管类器官还建立起包含 Dispase 消化、胰蛋白酶解离及 40μm 过滤器过滤的三步标准化流程,将原代组织的传代成功率提升至 85% 以上。
2. 无基质胶培养与水凝胶体系革新:同济大学开发的 BEX 扩增体系打破了传统基质胶的限制,该体系通过 5-DPM 培养基(含 RG108、A83-01、毛喉素等小分子抑制剂与 RSPO1 生长因子)与 HAHS 水凝胶的组合,实现了胆管类器官在 60 天内 3000 倍扩增,且可稳定传代 20 代以上。通过成分确定的化学微环境调控,该体系避免了基质胶批次差异带来的干扰,为胆管疾病建模与药物筛选提供了稳定的体外模型。
3. 功能维持与精准调控技术:日本研究团队发现,OSM(Oncostatin M)可通过激活 STAT3 通路,显著提升肝细胞类器官的代谢功能维持能力,使传代后细胞的尿素合成与药物代谢活性保留率提高 40% 以上。在病毒研究领域,呼吸道类器官通过引入 CYT387 抑制干扰素通路,首次实现人鼻病毒 C 在气道上皮类器官中的连续 5 次传代,而鼻类器官更展现出自发支持病毒传代的独特优势,为呼吸道病毒致病机制研究提供了全新工具。
4. 自动化与专用试剂系统开发:针对传代痛点,相关厂商推出了专用试剂盒,大幅降低了操作门槛。例如含鼠源特异性生长因子的培养基,可精准匹配肠道干细胞的自我更新需求;生物相容性水凝胶冻存试剂,能将类器官冻存复苏后的存活率提升至 90% 以上。最新研究显示,通过分群结构分析、时序分群占比密度矩阵构建及生长函数修正的自动化传代控制系统,可实现传代时机的精准判断,使培养效率提升 35%。
不同类器官特性不同,适用的传代方法也存在差异,具体选择可参考以下指南:
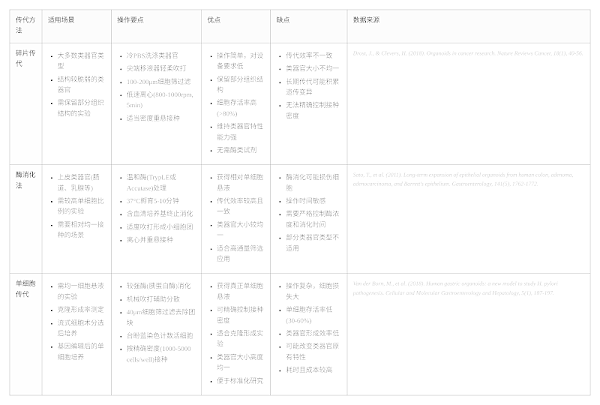
• 碎片传代:是多数类器官的首选方法,通过机械吹打获得 50-200μm 的细胞团块,既能兼顾细胞活性,又能保留其分化潜力。
• 酶消化法:适用于紧密连接的上皮类器官,常用 Tryple™Express 酶,操作时需严格控制消化时间,通常为 5-10 分钟。
• 单细胞传代:仅推荐用于克隆培养,且需添加 ROCK 抑制剂,以减少单细胞凋亡。
尽管类器官传代技术迭代迅速,但仍面临两大核心挑战。一方面,传代参数缺乏统一标准:肝癌类器官需 1:2 高比例传代以维持增殖活性,而甲状腺癌类器官则需 1:4 低比例传代避免过度拥挤,这种组织特异性差异导致跨实验室数据可比性差。另一方面,试剂盒兼容性不足:现有商用试剂盒多针对肠道、乳腺等常见类器官开发,对胆管、胰腺等特殊类型类器官的支持度有限,
近年来,国产类器官培养试剂盒也是层出不穷,比如济研的鼠源类器官一站式构建及传代试剂盒、类器官专用组织包埋胶(SE-Gel)等,采用纳米级亲水涂层微孔板,支持鼠源类器官悬浮培养,无需基质胶包埋,传代时直接收集细胞球,避免酶解损伤,细胞存活率提升至 90% 以上;传代后细胞倍增时间缩短至 24-36 小时(传统培养基需 48-72 小时);经 10 + 种鼠源肿瘤类器官(如胃癌、卵巢癌)传代验证,结构完整率达 85% 以上,为后续标准化流程设计与试剂盒选择指南提供了现实依据。
更多类器官培养试剂,基质胶,类器官培养基,试剂盒等实验耗材请进入苏州阿尔法生物进行了解。