

在细胞生物学和分子生物学研究中,CRISPR-Cas9 系统已成为基因功能解析与细胞模型构建的核心工具。尤其是基因定点敲入(Knock-in, KI)技术,在目的基因标记、人源化模型构建等场景中需求迫切 —— 例如通过荧光标签定位蛋白亚细胞结构,或在小鼠细胞中替换人源致病基因构建 CDX 肿瘤模型。然而,传统 KI 技术面临两大痛点:不同细胞系敲入效率 会有差异(部分原代细胞或难转染细胞效率低于 1%),且长片段(>1Kb)整合成功率低,严重制约功能基因研究与复杂疾病模型构建。

一、Cas9-CKI 技术的多策略突破路径
针对上述难题,苏州阿尔法生物 提供的 Cas9-Cell line Knock-In 服务(Cas9-CKI),通过精准匹配细胞特性与片段长度制定差异化方案:
小片段(<50bp):采用 Oligo DNA 直接同源重组,适用于荧光标签(如 GFP、mCherry)或点突变引入,在 HEK293 等易转染细胞中效率可达 30% 以上。
中长片段(50bp-1Kb):优化 ssDNA 单链模板递送体系,结合电转参数优化,在 HeLa、HCT116 等细胞系中实现稳定整合,解决传统双链 DNA 递送导致的非特异性连接问题。
超长片段(>1Kb):创新应用重组载体系统,通过构建 Cas9 稳转细胞株(如稳定表达 Cas9 的 A549 细胞系),配合环状质粒或 AAV 病毒载体递送,突破长度限制的同时将敲入效率提升 2-3 倍。
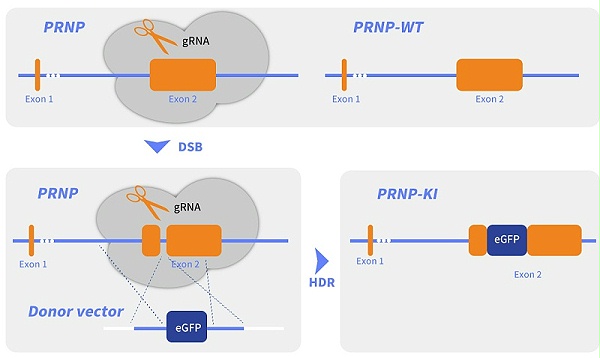
二、ClonePlus™服务的三大技术优势
苏州阿尔法生物提供的 ClonePlus™基因定点敲入细胞系构建服务,针对前沿研究需求形成独特技术壁垒:
1. 纯合克隆筛选与功能验证体系
通过单细胞克隆培养结合三代测序验证,确保获得 100% 纯合敲入细胞克隆(如 HPRT 位点纯合敲入 Luciferase 基因的 Jurkat 细胞系),避免杂合子干扰实验结果。配套蛋白水平验证(WB 检测标签表达、ELISA 验证分泌型蛋白功能),保障外源基因的稳定表达与生物学活性。
2. 精准化蛋白融合表达设计
基于细胞亚定位预测算法,优化标签插入位点(N 端 / C 端 / 内含子区域),例如在 U2OS 细胞中于波形蛋白(Vimentin)C 端融合 mTagBFP 荧光标签,既保留蛋白功能又实现细胞骨架动态实时成像。针对分泌蛋白,可定制信号肽序列提升胞外分泌效率(如人源 IL-10 在 CHO 细胞中的表达量提升 40%)。
3. 难转染细胞系专属解决方案
针对原代神经元、胚胎干细胞等难操作细胞,建立 “Cas9 预稳转 + 靶向递送” 技术平台:先通过慢病毒感染构建 Cas9 稳定表达细胞株(如小鼠原代皮层神经元 Cas9 稳转体系),再采用核转染技术递送高纯度 gRNA 核糖核蛋白复合体(RNP)与 ssDNA 模板,将敲入效率从传统方法的 5% 提升至 25%-30%。
三、前沿应用场景与技术价值
当前,该技术已在多个热门研究领域展现关键作用:
肿瘤免疫研究:在 NOD-SCID 小鼠来源的 CD34 + 造血干细胞中敲入人源 PD-1 基因,构建免疫重建 CDX 模型,精准模拟临床 PD-1 抑制剂疗效评价体系。
CAR-T 细胞开发:在 CAR-T 细胞中定点敲入 CD19 CAR 序列至 TRAC 位点,避免随机整合导致的插入突变风险,为异体 CAR-T 细胞制备提供标准化生产路径。
神经生物学研究:在 SH-SY5Y 细胞中敲入 α-synuclein 基因 A53T 突变体至内源性启动子下游,构建家族性帕金森病细胞模型,实现病理蛋白的生理水平表达。
四、CRISPR 技术优化与行业标准建设
Cas9X 团队通过千余次细胞系测试,建立包含 120 + 常用细胞的敲入参数数据库(涵盖 HEK293、HepG2、PC-3 等),针对每个细胞系优化核转染电压、Donor 浓度、筛选药物浓度等 20 + 关键参数。例如在 Caco-2 细胞中,通过降低电转脉冲时间并提高 ssDNA 浓度,将敲入效率从 8% 提升至 22%,相关技术参数已形成企业标准操作规范(SOP)。
随着 CRISPR 技术向体内编辑、多基因调控等方向发展,基因定点敲入的精准性与高效性成为突破瓶颈。苏州阿尔法生物 提供的Cas9-CKI 服务通过技术创新与标准化流程,为基础研究与转化应用提供从方案设计到稳定细胞系交付的全链条解决方案,助力攻克癌症机制解析、CAR-T 细胞产品开发等前沿课题。