

细胞共培养小室是实验室中用于模拟体内细胞间相互作用、实现不同类型细胞 “同环境分隔培养” 的专用工具,核心作用是在同一培养体系内物理分隔细胞,同时允许营养物质、信号分子等小分子自由流通,还原更接近生理状态的细胞研究环境。
一、基本定义与核心结构
细胞共培养小室通常为模块化设计,可适配常规细胞培养皿 / 板(如 6 孔、12 孔、24 孔板),核心结构分为三部分:
上室(Insert):用于接种一种细胞,底部为多孔滤膜,是实现 “分隔” 与 “交流” 的关键部件。
下室(Well):即培养板的基础孔,用于接种另一种细胞,与上室共用同一份培养基。
滤膜:决定共培养小室的核心功能,关键参数包括:
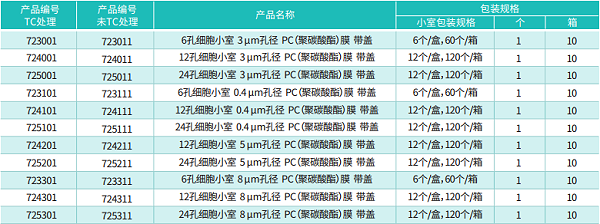
孔径:常见 0.4μm(允许小分子、细胞因子通过,阻止细胞迁移)、8.0μm(允许细胞迁移 / 侵袭,用于肿瘤转移、细胞趋化实验)。
材质:聚酯(PET)膜(透光性好,适配荧光显微镜观察)、聚碳酸酯(PC)膜(耐化学性强,适合长期培养)。
二、核心功能与研究价值
实现 “非接触式共培养”:物理分隔两种细胞,避免直接接触,仅通过培养基中的信号分子(如细胞因子、生长因子)研究旁分泌效应。
例:研究干细胞分泌的因子对肿瘤细胞增殖的影响,无需担心两种细胞混合。
模拟生理微环境:还原体内不同细胞 “相邻但不融合” 的状态,如上皮细胞与间质细胞、免疫细胞与靶细胞的相互作用。
开展特殊功能实验:搭配不同孔径滤膜,可拓展为细胞迁移实验(Transwell 迁移)、细胞侵袭实验(Matrigel 包被滤膜),研究细胞的运动能力。

|
关键参数 |
可选范围 |
适配实验场景 |
推荐小室类型 |
注意事项 |
|
膜材质 |
聚碳酸酯(PC)膜 |
药物转运、细胞分泌因子检测、大孔径迁移实验 |
Transwell/Millicell® |
孔径0.4-8.0μm,扩散效率高,不适合荧光检测 |
|
|
聚四氟乙烯(PTFE)膜 |
细胞形态观察、需胶原包被的粘附实验 |
Transwell |
仅0.4/3.0μm孔径,需提前包被胶原增强粘附性 |
|
|
聚酯(PET)膜 |
相差显微镜观察(透明)、荧光检测(遮光款) |
Transwell(透明)、FluoroBlok™(遮光) |
透明款可直接观察细胞,遮光款避免荧光干扰 |
|
膜孔径 |
0.4-1.0μm |
间接共培养(如T细胞-肿瘤细胞互作)、药物转运 |
Transwell/Millicell® |
仅允许分子通过,阻止细胞迁移 |
|
|
3.0-5.0μm |
类器官培养、轻度细胞迁移(如内皮细胞聚集) |
Millicell®(气液界面) |
适合需要细胞轻度互动但不大量迁移的场景 |
|
|
8.0μm |
肿瘤侵袭/趋化实验(如癌细胞迁移穿过膜) |
Transwell(需Matrigel包被) |
必须搭配Matrigel模拟体内基底膜 |
|
小室设计 |
杯状(适配常规培养板) |
6/12/24孔板基础实验、操作便捷性优先 |
Transwell |
直接放入培养板,无需额外支架 |
|
|
悬挂/站立式(气液界面) |
三维培养、上皮/类器官分化(如肺泡细胞) |
Millicell® |
需配套专用培养板,确保气液界面稳定 |
1. 实验前准备:
○ 小室处理:选择8.0μm孔径透明PET膜小室,用无血清培养基浸泡膜30分钟(激活膜亲水性)。
○ Matrigel包被:按1:8比例用无血清培养基稀释Matrigel,每孔加50-100μL(覆盖膜上表面),37℃孵育4-6小时至胶凝固。
2. 细胞铺板:
○ 上室:接种肿瘤细胞(密度1×10⁴ cells/孔,用无血清培养基悬浮),避免产生气泡(气泡会导致细胞无法贴壁)。
○ 下室:加入含10%血清的培养基(作为趋化因子来源),液面需与上室膜下表面接触(确保分子能穿透膜)。
3. 培养与观察:
○ 37℃、5%CO₂培养24-48小时(根据细胞侵袭能力调整时间)。
○ 结果检测:取出小室,用棉签轻轻擦去上室未穿透的细胞,甲醛固定下室侧细胞,结晶紫染色后,显微镜下计数穿透细胞数。
1. 实验前准备:
○ 选择悬挂式小室(适配6孔板),膜孔径3.0μm,用PBS冲洗2次,晾干备用。
○ 类器官预处理:将制备好的类器官(如肠道类器官)用胰酶轻微消化,制成单细胞悬液(密度5×10³ cells/cm²)。
2. 细胞铺板与环境构建:
○ 小室膜上表面接种类器官细胞,加入少量培养基(仅覆盖膜表面,避免淹没细胞)。
○ 培养板孔内加入足量培养基(液面距小室膜下表面1-2mm),构建“上室气、下室液”的气液界面。
3. 培养与分化:
○ 前2天用完全培养基培养(促进细胞贴壁),第3天更换分化培养基,每2天换液1次(仅更换下室培养基,避免触碰上室细胞)。
○ 培养7-14天后,通过相差显微镜观察类器官分化形态(如肠道绒毛结构)。
1. 细细胞共培养小室孔径选错了会有什么影响?
○ 孔径过小(如用0.4μm做肿瘤侵袭):细胞无法穿透膜,导致实验无结果;
○ 孔径过大(如用8.0μm做间接共培养):细胞会迁移到对侧,打乱分组,污染样本。
○ 解决方案:实验前先查目标细胞直径(如肿瘤细胞约10-20μm,需8.0μm孔径;免疫细胞约5-10μm,0.4μm即可阻断)。
2. 细胞密度怎么控制才合适?
○ 贴壁细胞:推荐10³ cells/cm²(如6孔板Transwell小室,每孔接种5×10⁴-1×10⁵ cells);
○ 悬浮细胞/类器官:密度可略高(1×10⁴ cells/cm²),但需避免过度拥挤导致营养不足。
○ 关键:预实验测试3个密度(低、中、高),选择24小时后覆盖率50%-70%的密度。
3.如何判断细细胞共培养小室的膜是否破损?
○ 方法1:未铺细胞前,向小室加少量亚甲蓝溶液,观察下室培养基是否变蓝(变蓝则膜破损,需更换小室);
○ 方法2:培养后若发现下室出现大量非目标细胞,大概率是膜破损导致细胞迁移。
更多细胞培养小室,Transwell 共培养实验指南,细胞共培养小室使用注意事项剂实验耗材相关问题请进入苏州阿尔法生物,0512-62956104或18934597460进行了解。