

类器官的构建依赖于具有多向分化潜能的细胞类型,主要来源包括:
| 方法 | 适用对象 | 技术要点 |
|---|---|---|
| 机械解离 | 脆弱组织(如脑组织) | 剪刀精细剪切→梯度离心→100μm滤网过滤 |
| 酶解法 | 致密组织(如肿瘤、肠道) | 胶原酶IV(1-2mg/ml)+分散酶(37℃,20-40min)→DNase I处理抑制细胞聚集 |
| 冷冻组织复苏 | 生物样本库样本 | 37℃水浴快速解冻→梯度稀释去除DMSO→PBS洗涤 |
注:细胞活性需>85%(台盼蓝染色检测),组织碎片大小控制在0.1-0.5mm³
球状体作为类器官发育的初级结构,其形成方法需根据细胞特性选择:
| 方法 | 原理 | 参数控制 | 适用场景 |
|---|---|---|---|
| 低吸附板培养 | 表面改性抑制细胞贴壁 | 细胞密度1×10⁴-5×10⁴ cells/ml | iPSCs/ESCs类器官 |
| 悬滴培养 | 重力驱动细胞聚集 | 液滴体积20-30μl,细胞密度5×10³ cells/drop | 均质球状体制备 |
| 旋转生物反应器 | 动力学微环境促进均匀生长 | 转速25-50rpm,剪切力<0.5Pa | 大规模生产(如肝类器官) |
| 微流控芯片 | 精确控制微环境参数 | 通道宽度100-200μm,流速0.1-10μl/min | 高通量筛选 |
培养基组成:基础培养基(DMEM/F12)+ B27(1:50)+ N2(1:100)+ 双抗(青霉素-链霉素)+ 特异性生长因子(如Wnt3a 50ng/ml)
球状体需包埋于细胞外基质(ECM)模拟物中,以提供结构支撑和生化信号:
| 基质类型 | 主要成分 | 浓度 | 固化条件 | 优缺点 |
|---|---|---|---|---|
| Matrigel® | 层粘连蛋白(60%)、胶原蛋白IV(30%) | 8-12mg/ml | 37℃,5-15min | 生物学活性高,批次差异大 |
| 胶原蛋白I凝胶 | 牛/鼠源胶原蛋白I | 2-3mg/ml | 37℃+0.1M NaOH | 机械强度可调,成本较低 |
| 合成肽水凝胶 | RGD序列修饰的PEG | 5-10% w/v | 光交联(365nm) | 成分明确,可定制化 |
| 脱细胞ECM | 组织来源脱细胞基质 | 3-5mg/ml | 温度敏感型固化 | 保留天然ECM拓扑结构 |
操作规范:基质与球状体悬液按1:1混合,快速接种于预冷培养板,避免提前固化
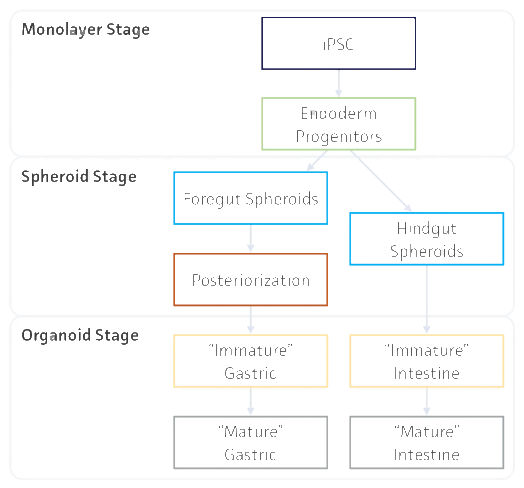
通过时序性添加生长因子组合,引导球状体向目标器官分化:
培养周期管理:
| 评估维度 | 检测方法 | 合格标准 |
|---|---|---|
| 形态结构 | H&E染色、免疫荧光 | 呈现器官特异性微结构(如肠绒毛、脑皮质层) |
| 细胞组成 | 流式细胞术、单细胞测序 | 含目标器官主要细胞类型(>80%) |
| 功能成熟度 | 电生理(脑类器官)、白蛋白分泌(肝类器官) | 功能指标达体内水平的30-50% |
| 遗传稳定性 | 核型分析、全基因组测序 | 无显著染色体畸变 |
类器官技术通过整合干细胞生物学、材料科学与生物工程学,实现了体外器官发育的高度模拟。随着血管化、免疫化及标准化技术的突破,类器官将在疾病建模、药物筛选、再生医学等领域发挥不可替代的作用。未来研究需聚焦于提升类器官生理相关性,推动其从基础研究向医学转化迈进,最终实现精准医学的个体化解决方案。
参考文献
[1] Clevers H. Modeling Development and Disease with Organoids. Cell. 2016
[2] Lancaster MA, Knoblich JA. Organogenesis in a dish: Modeling development and disease using organoid technologies. Science. 2014
[3] Sato T, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 2009