

使用传统体外方法生产的 EV 的深入表征和验证由于需要大面积的细胞单层和大量的培养基,培养可能具有挑战性。该实验方法使用贴壁细胞生物反应器系统以节省空间、资源和时间的方式同时培养多种不同亚型的乳腺癌细胞系,从而能够持续生产大量用于下游实验的 EV。
一、生物反应器接种、适应和维护
培养基 A:含有 10% 胎牛血清(FBS,Merck)和 1% 青霉素/链霉素(PS,Gibco)的 DMEM(Gibco)。
培养基 B:Advanced DMEM/F-12(Gibco)、2% CDM-HD (Fibercell)、2% FBS、1% Glutamax (Gibco) 和 1% PS。
培养基C:高级 DMEM/F-12、2% CDM-HD、1% Glutamax (Gibco) 和 1% PS。
将细胞密度培养为1.5 × 10 6 个细胞/ml 的 15 mL细胞重悬液接种到贴壁生物反应器的下部细胞室中( Argos) 并在上层培养基室中加入 500 ml 相同培养基. 通过用培养基 A 代替培养基 C,细胞逐渐适应 CDM-HD 血清替代品(Fibercell Systems)和高级 DMEM/F12(以尽量减少 FBS 的使用)。细胞室每 3-4 天更新一次,培养基室更新一次每周。1 周后,培养基更改为 75%培养基A 和 25%培养基B。接下来的一周更改为 50% 培养基 A 和 50%培养基B,然后下一周更改为 25% 培养基 A 和 75%培养基 B。最后,在第 4 周,细胞室用 15 ml 预热的 PBS 仔细清洗 3 次以去除任何残留的 FBS EV,并填充 15 ml 培养基 C,同时培养基室保持 500 ml 培养基 B。
适应后,从细胞室收集 15 ml 条件培养基用于 EV 分离,并每 3-4 天(星期一和星期四)更新一次,而细胞室每 7 天(星期四)更换一次。每次更换时记录细胞室培养基体积(ml)。通过将 10 μl 完全条件培养基与 1:1 台盼蓝混合并在细胞计数仪上进行观察和计数,将其用于悬浮细胞的定量。数字以“EV Collection #”表示,其中 EV Collection #1 对应于接种后 28 天,此后每周进行两次收集。
二、常规培养物比较
BT-474 和 MDA-MB-231 细胞在 2D 烧瓶中进行血清饥饿培养,以将 EV 产量与生物反应器培养物进行比较。简而言之,细胞在标准条件下在含有 10% FBS 和 1% P/S 的 DMEM 中培养,并通过使用 TrypLE (Gibco) 在其生长期(~80% 汇合度)分裂和重新接种,将每个培养瓶增至 9× T175 烧瓶. 将 9 × T175 烧瓶接种在含血清培养基中,达到约 30% 的汇合度,一旦细胞达到约 60% 的汇合度,就用 PBS 洗涤 3 次以去除任何残留的外源性 FBS EV,并在 50 ml DMEM 中加入 1将 % P/S 添加到每个烧瓶中。48 小时后,收集条件培养基并以 2000× g离心10 分钟,然后使用 Vivaspin 50、100 kDa 浓缩器浓缩,将培养基体积从 450 毫升减少到 40 毫升。使用尺寸排阻色谱法(SEC)对来自这种浓缩条件培养基的 EV 进行超速离心和纯化。
在接种前,使用支原体染色试剂盒 (Sigma-Aldrich) 对常规细胞培养物和在生物反应器中生长的培养物进行支原体检测。
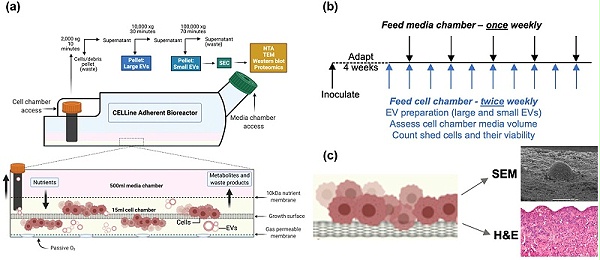
生物反应器实验和维护示意图。(a) 双室 CELLine AD 1000 生物反应器图和用于分离和表征 EV 的工艺流程; (b) 生物反应器维护方法显示在接种和培养基适应(4 周)后每周收集两次 EV,每周更新一次培养基室;(c) 解构后对生物反应器生长表面进行成像的方法,包括 SEM 和 H&E 。
三、外泌体 EV隔离
将来自生物反应器细胞室的 15 ml 条件培养基以 2000 × g离心10 分钟以去除细胞和其他碎片。然后按照制造商的说明使用高速离心机将上清液与 PBS 混合以达到小体积的 20 ml,以 10,000 x g离心30 分钟以沉淀大型 EV(也称为微泡)和该颗粒重新悬浮在 500 μl PBS 中并储存。然后将上清液以 100,000 x g超速离心70 分钟以产生粗制小 EV 颗粒。将该沉淀重悬于 700 μl PBS 中并储存在 -80°C 直至需要,尽量减少冷冻解冻的次数。
将 500 μl 粗小型 EV 加载到 35 nm qEV Original SEC 柱上,并使用自动馏分收集器(每个馏分 500 μl)收集馏分 7 至 23。对每个收集的级分进行高灵敏度 BCA 测定(Pierce,ThermoFisher Scientific)以确定它们的蛋白质浓度。一旦确定了富含 EV 的分数,只有那些富含 EV 的分数(由 NTA 填充的颗粒;F8-F10)被收集并汇集在随后的分离中。
四、纳米粒子追踪分析
在 PBS 中以 1:100 的比例稀释 SEC 纯化的小型 EV 个体和合并的级分,并使用 NS300 Nanosight(Malvern Analytical)或Nanocoulter Ⅰ进行测量。在低流量条件下进行表征分析,如:平均和众数粒径、浓度、电位和尺寸分布。汇集了富含 EV 的部分,并用于跟踪 EV 生产、TEM 和质谱分析。使用 Kruskal-Wallis 检验在 Graphpad Prism 中对每个细胞系的 EV 产量和 EV 相关蛋白进行统计比较(P < 0.05) 在包括 Kolmogorov–Smirnov 和 Shapiro–Wilk 测试在内的正态性测试呈阴性后。平均值以±标准偏差报告。散点图以平均值和标准偏差呈现。
五、透射电镜分析
通过吸附到 Formvar 涂层铜网格(电子显微镜科学)上 10 分钟,对小型 EV 进行负染色 TEM。用滤纸(Whatman)去除多余的液体,然后将铜网格转移到 20 μl 已过滤的 2% 乙酸双氧铀中 2 分钟。用滤纸除去多余的液体,让网格干燥 10 分钟。网格在 TEM 上以 120 kV 加速电压可视化,并拍摄图像。
六、 免疫印迹
合并的小型 EV 以 100,000 × g超速离心浓缩70 分钟,并通过 BCA 测量蛋白质水平。通过 SDS-聚丙烯酰胺凝胶电泳分离等量(4 μg/泳道)的 SEC 纯化的小型 EV 和细胞裂解物,并转移至 PVDF 膜( Millipore) 。为防止非特异性结合,将膜与封闭溶液一起孵育使用 Pierce ECL Western Blotting Substrate (ThermoFisher Scientific) 使结合的抗体可视化,并使用化学发光凝胶成像系统进行分析。
七、无标记蛋白质组学分析(SWATH-MS)
将EV 在真空浓缩器(中浓缩至 150 μl 的体积。加入 150 μl 7 M 尿素、2 M 硫脲、5 mM DTT、0.1% SurfactAmps X-100 的 50 mM 碳酸氢铵溶液后,将样品在声波浴中超声处理 15 分钟。通过在 56°C 的加热块中孵育 20 分钟来减少二硫键。 而后样本处理后进行SWATH 分析。
苏州阿尔法生物专注于实验室仪器设备和实验器材供应14年,提供的实验设备包括:生物反应器、PCR仪、振荡培养箱、高速离心机、细胞计数仪、凝胶成像仪、电泳仪、粒径分析仪、流式细胞仪、显微镜等广泛用于EV分析和外囊泡的表征研究等。更多仪器设备和试剂耗材可 0512-62956104或 18934597460咨询。