

抗体-药物偶联物(ADC)由于其结构和功能的复杂性而存在独特的分析挑战,动态体内生物转化途径需要复杂的生物分析方法。 ADC 的主体是抗体,所以ADC的药代动力学与未偶联的单克隆抗体有许多相似的地方,例如半衰期长、清除率低等。然而,偶联小分子药物导致ADC异质性增加,因此不仅需要通过 ELISA 实现精准定量,还需借助电泳分离、发光检测等技术验证ADC完整性与偶联效率——这一过程中,可靠的实验设备是确保分析结果准确性的关键支撑。
本文以Trastuzumab-MMAE(曲妥珠单抗-MMAE,HER2 靶向 ADC)为例,系统比较ADC药代动力学评估的通用与特异性检测方法,详细阐述方法开发、验证流程及实验室仪器设备的 应用场景,为ADC 定量分析提供 “方法+ 设备 ” 的完整解决方案。
实验材料和方法
1. 总抗体生物分析测定
我们开发并评价了用于定量Trastuzumab-MMAE总抗体的三种ELISA方法,核心依赖荧光酶标仪 实现吸光度精准读取:
① 通用夹心ELISA法:抗人IgG 多克隆抗体同时捕获和检测抗体);
② 通用夹心ELISA法:捕获抗体为抗人IgG 单克隆抗体,检测抗体为抗人 IgG多克隆抗体;
③ 间接ELISA法:捕获试剂为人HER2 ,检测抗体为抗人 IgG抗体。
图1. 开发并评估定量分析Trastuzumab-MMAE总抗体的三种方法
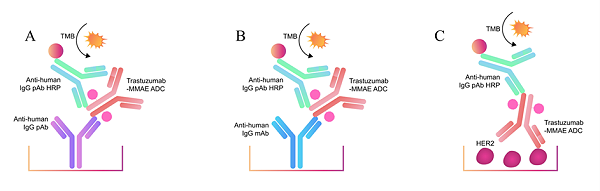
(图注:包含TMB、抗人IgG抗体、 Trastuzumab-MMAE ADC、 HER2等关键组分的作用示意)
2. 结合抗体的特异性ELISA
针对Trastuzumab-MMAE偶联抗体的定量,除ELISA核心流程外,需通过Western Blot+化学发光成像 验证偶联效率,具体方法如下:
① 特异性夹心ELISA法:抗MMAE 抗体为捕获抗体,生物素化 HER2结合ADC和 HRP-SA 为检测抗体;
② 特异性间接ELISA法:抗MMAE 抗体为捕获抗体,抗人 IgG单克隆抗体为检测抗体;
③ 辅助验证:采用SDS-PAGE分离Trastuzumab 与 Trastuzumab-MMAE,通过化学发光成像确认偶联后蛋白分子量变化,排除未偶联抗体干扰。
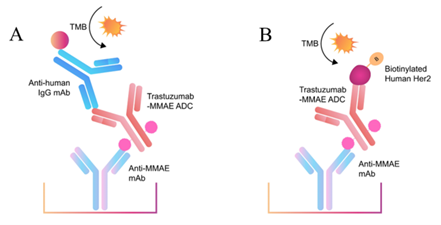
图2. 开发并评估两种方法定量Trastuzumab-MMAE特异性抗体
(图注:原文图示,展示抗MMAE抗体作为捕获试剂,与Trastuzumab-MMAE ADC的结合及后续检测流程)
3. 实验试剂与设备
表1. 主要试剂
|
Materials |
Catalog No. |
Vendor |
|
Affinity Purified Antibody to Human IgG (Fc) |
5210-0165 |
KPL |
|
Trastuzumab-MMAE |
HY-164992 |
MCE |
|
Peroxidase AffiniPure Goat Anti-Human IgG, Fcγ fragment specific |
109-035-098 |
Jackson |
|
Monoclonal Anti-Human-IgG-Fc Antibody (Mouse IgG1) |
IGG-S307 |
ACROBiosystems |
|
Human HER2 (His Tag) |
HE2-H5225 |
ACROBiosystems |
|
Biotinylated Human HER2 (His, Avitag) |
HE2-H82E2 |
ACROBiosystems |
|
Costar 1×8 Stripwell (high binding) |
42592 |
Corning |
|
TMB |
A600954 |
BBI Life sciences |
|
BSA |
NA |
Yancheng Saibao |
表2. ELISA所用试剂
|
Conditions |
Description |
|
Coating Buffer(包被缓冲液) |
15 mmol/L Na₂CO₃, 35 mmol/L NaHCO₃, 7.7 mmol/L NaN₃, pH9.6 |
|
Washing Buffer(洗涤缓冲液) |
0.05% Tween-20 in TBS, pH7.4 |
|
Blocking Buffer(封闭液) |
2% BSA in Washing Buffer, pH7.4 |
|
Sample Dilution Buffer(样本稀释液) |
0.5% BSA in Washing Buffer, pH7.4 |
|
Antibody Dilution Buffer(抗体稀释液) |
0.5% BSA in Washing Buffer, pH7.4 |
|
Substrate Solution(底物溶液) |
8 μl 3% H₂O₂ + 100 μl 10 mg/mL TMB in 10 mL Substrate Solution A (50 mmol/L NaHPO₄·12H₂O, 25 mmol/L Citric acid, pH5.5) |
|
Stop Solution(终止液) |
1 mol/L sulfuric acid |
表3. 核心实验设备(来自天能,适配ADC分析全流程)
|
设备名称 |
型号 |
用途 |
|
荧光酶标仪 |
天能 Feyond-F100 |
ELISA实验中450 nm波长吸光度(OD₄₅₀)读取,支持空白对照扣除与数据自动计算 |
|
微型垂直电泳槽 |
天能 VE-180 |
SDS-PAGE实验中Trastuzumab/MMAE偶联蛋白的垂直电泳分离,适配小样本量(10-20 μL/孔),分离效率高 |
|
多功能小号水平电泳槽 |
天能 HE-90 |
用于Western Blot转膜前的凝胶平衡,或核酸电泳辅助验证,兼容多种凝胶尺寸 |
|
化学发光凝胶成像仪 |
天能 Tanon 4800 |
Western Blot化学发光信号检测,精准捕捉HRP-TMB反应的发光信号,验证ADC偶联效率 |
|
全自动发光成像系统 |
天能 Tanon Chemi Dog 5200T |
高通量化学发光成像,支持多通道检测与定量分析,可批量验证不同批次ADC的偶联一致性 |
|
全自动凝胶成像系统 |
天能 Tanon 4100 |
PAGE胶紫外成像,用于电泳后凝胶质量检查(如蛋白条带完整性、无拖尾),确保后续实验可靠性 |
4. 实验流程
4.1 ELISA定量流程
1.
包被:用包被缓冲液稀释蛋白(抗人IgG/HER2),加入酶标板(42592 ,Corning ),4℃孵育过夜( 16 h );
2.
洗涤:每孔加300 μL洗涤缓冲液洗4 次,彻底去除残留液,倒置酶标板干燥;
3.
封闭:每孔加300 μL封闭缓冲液,37℃ 孵育1 h ;
4.
洗涤:重复步骤2;
5.
加样:100 μL梯度稀释的Trastuzumab-MMAE 样本(样本稀释液稀释),37℃ 孵育1 h;
6.
洗涤:重复步骤2;
7.
加检测抗体:100 μL HRP标记抗体(抗体稀释液稀释),37℃ 孵育1 h ;
8.
洗涤:重复步骤2;
9.
加底物:200 μL底物溶液,37℃ 避光孵育20 min ;
10.
终止反应:每孔加50 μL 1 mol/L硫酸;
11.
吸光度读取:使用天能Feyond-F100荧光酶标仪 ,在450 nm波长下读取 OD值,自动计算 “ 最终OD值 = 样本 OD₄₅₀- 空白孔OD₄₅₀”。
4.2 ADC偶联效率验证流程
1.
蛋白样品制备:取Trastuzumab(裸抗)与Trastuzumab-MMAE (偶联物)各 20 μg,加入5×SDS上样缓冲液, 95℃变性5 min ;
2.
电泳分离:将样品加入天能VE-180垂直电泳槽 的凝胶孔中,设置电压(浓缩胶80 V,分离胶 120 V),电泳 60-90 min 至溴酚蓝到达凝胶底部;
3.
转膜与孵育:将凝胶转移至PVDF膜,封闭后加入抗人IgG-Fc 抗体(1:5000 稀释),4℃孵育过夜,再加入 HRP二抗(1:10000 稀释), 37℃ 孵育1 h;
4.
化学发光检测:膜上滴加ECL底物,放入天能Tanon 4800化学发光凝胶成像仪 ,曝光1-5
min ,观察条带:Trastuzumab-MMAE条带分子量150 kDa ),确认偶联成功;
5.
凝胶质量检查:电泳后的PAGE胶放入天能Tanon 4100全自动凝胶成像系统 ,紫外灯下观察条带完整性,无拖尾则说明分离合格。
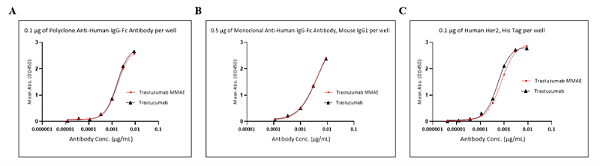
1. 总抗体检测结果
三种ELISA方法在测试浓度范围内均表现出优异线性(R²>0.99),裸抗与 Trastuzumab-MMAE 的检测灵敏度相当,说明药物偶联未影响抗体识别。通过天能Feyond-F100荧光酶标仪 的精准读数,方法① (双抗人 Fc多克隆抗体法)的批间精密度( CV<15%)与回收率(90%-110% )最优,确立为总抗体定量的首选方法。
2. 偶联抗体检测与设备辅助验证结果
两种特异性ELISA方法均表现出稳定性能(R²>0.99, CV<15%),不同抗 MMAE抗体克隆株(M1H09/M1G04 )无显著差异(图5 A-B)。通过天能VE-180电泳槽+Tanon 4800成像仪 的辅助验证,Western Blot结果显示:Trastuzumab-MMAE条带分子量较裸抗增加约 5-10 kDa ( MMAE偶联导致),且无未偶联裸抗条带,说明 ELISA 检测的偶联抗体均为有效偶联产物,排除假阳性干扰。

本研究通过“ELISA定量+电泳 / 成像验证”的组合策略,实现了Trastuzumab-MMAE 总抗体与偶联抗体的精准分析,其中适配的实验设备 为实验可靠性提供了关键支撑:
•
天能Feyond-F100荧光酶标仪确保ELISA吸光度读取的准确性,减少空白干扰与人为误差;
•
天能VE-180/HE-90电泳槽实现ADC蛋白的高效分离,为偶联效率验证奠定基础;
•
天能Tanon 4800/Chemi Dog 5200T成像系统精准捕捉化学发光信号,直观验证ADC
偶联完整性。
在ADC药代动力学分析的实际应用中,建议结合“方法选择 +实验室仪器设备适配 ” 双重维度:先选择双抗人Fc 多克隆抗体 ELISA法(总抗体)与抗 MMAE 夹心 ELISA 法(偶联抗体),同时搭配天能电泳
-成像设备组合进行辅助验证,确保分析结果的准确性与可重复性。
此外,Tanon Chemi Dog ULTRA全自动发光成像系统、Tanon 1600凝胶成像仪可兼容不同实验规模(从小样本验证到高通量筛选),为 ADC 的全开发周期提供稳定的技术支持。