

脂肪间充质干细胞成软骨诱导分化试剂盒
脂肪间充质干细胞成软骨诱导分化试剂盒规格: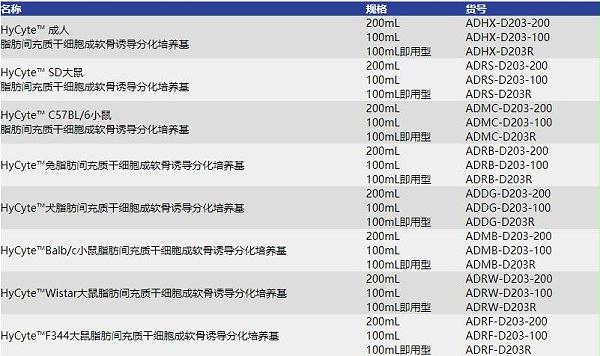
质检标准 pH:7.2~7.4
内毒素含量:<10 EU/mL
生物安全:细菌、真菌、支原体检测阴性
质量检测:诱导测试合格
| 检验原理
阿利辛蓝广泛用于酸性多糖的染色,如软骨 或组织中的糖胺聚糖和细胞分泌的外被多糖的 染色等。干细胞在诱导培养基的作用下,会逐渐 向软骨细胞方向分化。软骨细胞外具有一层富含 蛋白多糖的基质,是成软骨分化的标志物,可被 阿利辛蓝染成蓝绿色。
成软骨诱导分化操作(平面诱导)
1. 细胞分化诱导
将对数生长期的细胞消化下来计数,成软骨 诱导分化培养基诱导液重悬细胞,离心后调整细 胞密度密度1.0~2.0×10e7cells/mL。 吸取20 μL细胞悬液(约2.0~4.0×10e5个细胞) 悬滴至24孔板中央。置于37℃,5% CO2培养环境 下培养2~3 h使细胞贴壁。 2~3 h后补充1 mL成软骨诱导分化培养基诱 导液正常培养。每隔2~3天换液一次。按照以上 换液频率诱导21~28天,并注意观察细胞形态变 化。
2. 染色鉴定
2.1 细胞固定 吸去培养基使用适量 1×PBS 清洗一次,弃去 后取适量 4%中性甲醛溶液覆盖培养器皿底面,室 温固定 30~60 min 后,弃去固定液再使用 1×PBS 清洗两次。
2.2 阿利辛蓝染色 向清洗干净的诱导孔内加入适量染色液,避 光静置染色 30 min。 吸去阿利辛蓝染色液,用 1×PBS 清洗两次, 并加入适量 1×PBS 避免细胞干燥。
2.3 诱导评估 显微镜下观察成软骨染色效果,并进行图像 采集和诱导评估。诱导成功时,软骨组织中的内 酸性粘多糖可被阿利辛蓝染成蓝绿色。
1. 干细胞的准备
将对数生长期的细胞消化下来计数,取 3×10e5 个细胞转移到 15 mL 离心管中,250 g 离 心 4 min。 弃上清,加入 0.5 mL 成软骨诱导分化培养基 预混液,重悬细胞,150 g 离心 5 min。小心弃去 上清,加入 0.5 mL 成软骨诱导分化培养基诱导 液,重悬细胞,150 g 离心 5 min。 将 15 mL 离心管的管盖稍稍旋开,放置于 37℃,5% CO2培养环境下培养。
2. 细胞分化诱导
24 h 后观察细胞沉淀形变团聚的情况,如有 明显的变化,则小心轻柔地拨动管底,尝试让细 胞团脱离管底,全部浸润在诱导液中。 置于 37℃,5% CO2培养环境下培养约 21 天, 通常每 2 天更换一次新鲜配制的成软骨诱导分化 培养基诱导液。注意观察细胞团成球情况及表面 光滑度,决定终止细胞诱导的时间,并进行染色 鉴定。
3. 染色鉴定
3.1 软骨球固定 将软骨球从离心管中转移至 EP 管,并使用 1 ×PBS 清洗两次,最后置于适量的 4%中性甲醛溶 液中。
3.2 石蜡包埋切片 软骨球经石蜡包埋后切片。
3.3 阿利辛蓝染色 将石蜡切片脱蜡和脱水,使用阿利辛蓝染色 液染色 30 min,用自来水冲洗 2 min,蒸馏水冲 洗 1 次。
3.4 诱导评估 显微镜下观察成软骨染色效果,并进行图像 采集和诱导评估。诱导成功时,软骨组织中的内 酸性粘多糖可被阿利辛蓝染成蓝绿色。
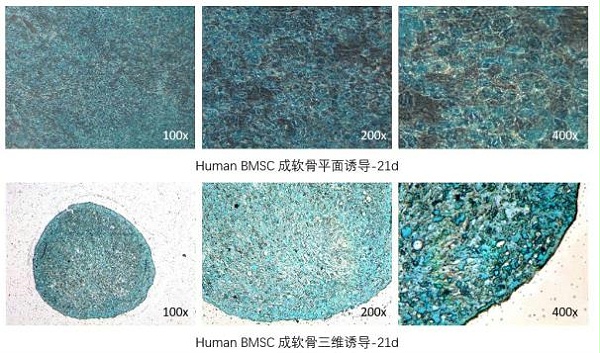
NOTE: 干细胞的成软骨分化水平因细胞类型、细胞供体 来源,培养条件、细胞代次、细胞状态和分化时间等因素而异。