

细胞凋亡检测试剂盒原理: 细胞凋亡早期改变发生在细胞膜表面,这些细胞膜表面的改变之一是磷脂酰丝氨酸(PS) 从细胞膜内转移到细胞膜外,使 PS 暴露在细胞膜外表面。Annexin V 具有易于结合到磷脂类如 PS 的特性,对 PS 有高度的亲和性。因此,该蛋白可充当一敏感的探针检测暴露在细胞膜表面的 PS。因此,可以采用 Annexin V 与 PI 双染的方法,通过流式检测细胞早期凋亡。
细胞凋亡检测试剂盒(Annexin V-Alexa Fluor 647/PI)
货号 规格
BDLS4002-20 20T
BDLS4002-50 50T
BDLS4002-100 100T
检测方法:采用 Annexin V 与 PI 双染的方法
储存条件:2-8℃避光保存(勿冰冻)
细胞凋亡检测试剂盒介绍:
细胞凋亡早期改变发生在细胞膜表面,这些细胞膜表面的改变之一是磷脂酰丝氨酸(PS) 从细胞膜内转移到细胞膜外,使 PS 暴露在细胞膜外表面。PS 是一种带负电荷的磷脂,正常 主要存在于细胞膜的内面,在细胞发生凋亡时细胞膜上的这种磷脂分布的不对称性被破坏而使 PS 暴露在细胞膜外。
Annexin V 具有易于结合到磷脂类如 PS 的特性,对 PS 有高度的亲和性。因此,该蛋白可充当一敏感的探针检测暴露在细胞膜表面的 PS。PS 转移到细胞膜外不是凋亡所独特的,也可发生在细胞坏死中。两种细胞死亡方式间的差别是在凋亡的初始阶段细胞膜是完好的,而细胞坏死在其早期阶段细胞膜的完整性就破坏了。因此,可以采用 Annexin V 与 PI 双染的方法,通过流式检测细胞早期凋亡。
注意事项:
本试剂盒需使用流式细胞仪进行检测。此产品仅供研究,不用于临床
试剂盒组份
1. 结合缓冲液 4× (Binding Buffer 4×) 体积:20 Tests: 4ml(4 倍浓缩液) 50 Tests: 10ml(4 倍浓缩液) 100 Tests: 20ml(4 倍浓缩液)
稀释后溶液中各组分浓度:10mM Hepes/NaOH, pH 7.4, 140mM NaCl, 2.5mM CaCl2 2. 碘化丙锭溶液 (Propidium Iodide, PI)
体积: 20 Tests: 0.2ml; 50 Tests: 0.5ml ;100 Tests: 1.0ml
浓度: 20μg/ml
3. 重组人 Annexin V/Alexa Fluor 647 , (rh Annexin V/Alexa Fluor 647 )
来 源:大肠杆菌(E.coli) 分 子 量:35.8 KDa
样 品 量:
20 Tests: 0.1ml,可用于 20 次实验
50 Tests: 0.25ml,可用于 50 次实验
100 Tests: 0.5ml,可用于 100 次实验
保存方法:于 50mM Tris, 100mM NaCl, 1%BSA, 0.02%NaN3,pH7.4 溶液中保存
纯 度:SDS-PAGE 及反相 HPLC 表明纯度大于 98%
生物活性:Annexin V 可结合于磷酯酰丝氨酸并表现出抗磷酯酶活性
实验操作步骤
1. 细胞样品的准备:
a)对于贴壁细胞:小心收集细胞培养液到一离心管内备用。用不含 EDTA 的胰酶消化细胞, 至细胞可以被轻轻用移液管或枪头吹打下来时,加入前面收集的细胞培养液,吹打下所有的 贴壁细胞,并轻轻吹散细胞。再次收集到离心管内。
1000rpm 左右离心 5min,沉淀细胞。 对于特定的细胞,如果细胞无法完全离心至离心管底,可以适当延长离心时间或稍稍加大离 心力。小心吸除上清,可以残留约 50µl 左右的培养液,以避免吸走细胞。
加入约 1ml 4℃预 冷的 PBS,重悬细胞,再次离心沉淀细胞,小心吸除上清。
b)对于悬浮细胞:1000rpm 左右离心 5min,沉淀细胞。对于特定的细胞,如果细胞无法完全 离心至离心管底,可以适当延长离心时间或稍稍加大离心力。小心吸除上清,可以残留约 50µl 左右的培养液,以避免吸走细胞。加入约 1ml 4℃ 预冷的 PBS,重悬细胞,再次离心 沉淀细胞,小心吸除上清。
2. 用去离子水按 1:3 稀释结合缓冲液(4ml 4x 结合缓冲液+12ml 去离子水);
3. 用 1x 结合缓冲液重新悬浮细胞,调节其浓度为 1-5x106 /ml;
4. 取 100μl 的细胞悬液于 5ml 流式管中,加入 5μl Annexin V/Alexa Fluor 647 和 10μl 20μg/ml 的碘化丙锭溶液;混匀后于室温避光孵育 5 分钟;
5. 加入 10ul 20ug/ml 的碘化丙锭溶液(PI),并加 400μl PBS,立刻流式检测。
实验设计:
1)未转染细胞 空白管:阴性对照组细胞,不加 Annexin V/Alexa Fluor 647 ,碘化丙锭溶液(PI)。用于调节电压。
检测管:处理的细胞,加 Annexin V/Alexa Fluor 647 ,碘化丙锭溶液(PI)。
用空白管和单阳 管调节好电压补偿后,获得所需要的流式数据。
注:无需用单染管 Annexin V/Alexa Fluor 647 调补偿。
2) 转染 GFP 细胞 未转染空白管:未转染细胞,不加 Annexin V/Alexa Fluor 647,碘化丙锭溶液(PI)。
用于调节 电压 转染 GFP 空白管:转染 GFP 对照组细胞,不加转染 Annexin V/Alexa Fluor 647,碘化丙锭 溶液(PI)。
用于调节补偿 检测管:处理的细胞,加 Annexin V/Alexa Fluor 647,碘化丙锭溶液(PI)。调节好电压补偿 后,获得所需要的流式数据。
常见问题:
1、 Annexin V/ PI 凋亡检测的试剂盒能否检测人以外其他动物的细胞凋亡情况?
可以。因为 Annexin V 是与磷脂酰丝氨酸(PS)亲和,而 PS 在不同种属间没差异。在正常细胞中,PS 只 3 / 3 分布在细胞膜脂质双层的内侧,而在细胞凋亡早期,PS 由脂膜内侧翻向外侧。
2、 贴壁细胞做凋亡用胰酶消化下来对细胞膜损伤?
低浓度胰酶消化,轻柔吹打贴壁细胞 2~3 次,离心机 4℃1000rpm 5min 离心,处理得当的话,胰酶造成 损伤可以控制在 5%以内,有对照组的情况下对实验结果不会造成明显影响。
3、 贴壁细胞可以先染 PI 然后再消化下来吗?
这样是否可以减小由于消化液造成的细胞 膜破损而染上的 PI 的误差?
先加 PI 不仅染色是否每组都均匀充分很难判断,而且 PI 本身对细胞也是有毒性的,对实验结果影响会 比胰酶大,不建议这样做。
4、 为什么只能用不含 EDTA 的胰酶消化贴壁细胞,用含 EDTA 的胰酶消化细胞对结果有 什么影响?
因为 Annexin V 是 Ca 依赖的蛋白,所以不能加入 EDTA,防止 EDTA 螯合了 Ca 离子从而影响 Annexin V,进而影响结果。
5、 有些厂家说明书 Annexin V 和 PI 一起加?为什么你们先加 Annexin V 后加 PI?
用流式检测凋亡时,PI 受时间的影响很大,因标记了 PI 后会加大细胞毒性,随着时间延长会导致 PI 的 染色增加,特别是检测早期凋亡时,如果时间延长除了会导致在流式细胞仪上的细胞分群差距加大外,误 差会明显加大。一般 PI 加上后立刻上机,然后在一个小时内检测完成。两种方法都可以,但是按照我们 操作步骤造成的误差会更小。
6、 你们哪种凋亡检测试剂盒能用于转染 GFP 细胞的凋亡检测?
BDLS4004 Annexin V-PE/7-AAD Apoptosis Detection Kit 凋亡检测试剂盒 BDLS4002 Annexin V-Alexa Fluor 647/PI Kit
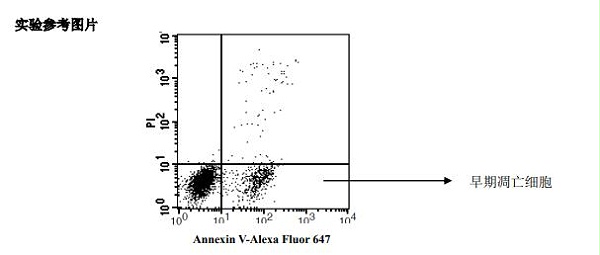
细胞凋亡检测试剂盒 凋亡检测试剂盒 实验参考图片 Jurkat 细胞用顺铂诱导凋亡后用 Annexin V-Alexa Fluor 647/PI 双染流式分析图谱