

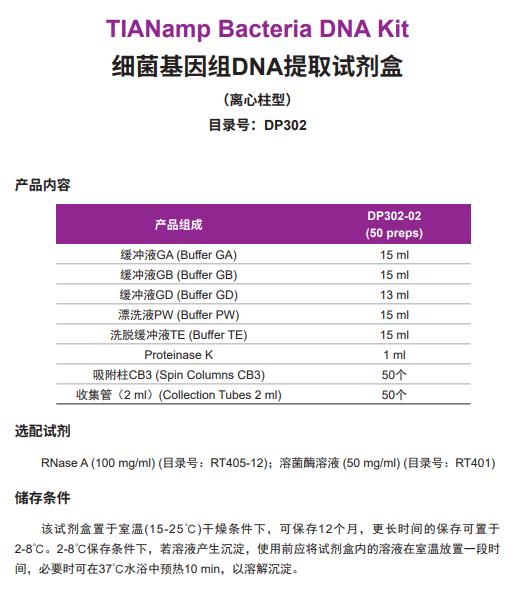
天根试剂盒-细菌基因组DNA提取试剂盒 DP302
产品简介
细菌基因组DNA提取试剂盒 DP302采用离心吸附柱和缓冲液系统,既适用于革兰氏阴性菌基因组DNA的提取,也可适用于革兰氏阳性菌基因组DNA的提取。
本试剂盒也可用于食品致病菌(微生物) 基因组提取,如:金黄色葡萄球菌、霍乱弧菌、出血性大肠杆 菌O157:H7、单增李斯特、沙门氏菌、阪崎肠肝菌等。可从1-5 ml细菌培养液中,快速提取纯化10-40 μg 纯净的基因组DNA,所得基因组DNA可直接用作PCR 模板、酶切、杂交等分子生物学实验。
产品特点
■ 简单快速:革兰氏阴性菌在1小时内可获得高质量的基因组DNA。
■ 质量好:DNA可直接用于PCR、酶切、杂交等分子生物学实验。
下游应用
■ 革兰氏阴性菌基因组提取。
■ 革兰氏阳性菌基因组提取。
■ 食品中致病菌基因组提取。
自备试剂
溶菌酶( 革兰氏阳性菌)、溶菌酶缓冲液(20 mM Tris, pH8.0; 2 mM Na2-EDTA; 1.2%Triton-100 )

注意事项
请务必在使用本试剂盒之前阅读此注意事项。
1.样品应避免反复冻融,否则会导致提取的DNA片段较小且提取量也下降。
2.若缓冲液GA或GB中有沉淀,可在37℃水浴中重新溶解,并摇匀后使用。
3.所有的离心步骤均为使用台式离心机,室温下离心。
操作步骤 使用前请先在缓冲液GD和漂洗液PW中加入CH3CH2OH,加入体积请参照瓶上的标签。
1. 取细菌培养液1-5 ml,10,000 rpm(~11,500×g)离心1 min,尽量吸净上清。
2. 向菌体沉淀中加入200 μl缓冲液GA,振荡至菌体彻底悬浮。
注意:对于较难破壁的革兰氏阳性菌,可略过第2步骤,加入溶菌酶溶液进行破壁处 理。
具体方法为:加入110 µl缓冲液(20 mM Tris, pH 8.0;2 mM Na2-EDTA;1.2% Triton),和70 µl溶菌酶溶液(50 mg/ml,客户自备,目录号:RT401),37 ℃处理30 min以上。如果需要去除RNA,可加入4 μl RNase A(100 mg/ml)溶液(客户自备,目 录号:RT405-12),振荡15 sec,室温放置5 min。
3. 向管中加入20 μl Proteinase K溶液,混匀。
4. 加入220 μl缓冲液GB,振荡15 sec,70 ℃放置10 min,溶液应变清亮,简短离心以去除 管盖内壁的水珠。
注意:加入缓冲液GB时可能会产生白色沉淀,一般70℃放置时会消失,不会影响后续实 验。
如溶液未变清亮,说明细胞裂解不彻底,可能导致提取DNA量少和提取出的DNA不 纯。
5. 加220 μl CH3CH2OH,充分振荡混匀15 sec,此时可能会出现絮状沉淀,简短离心以去除管盖内壁的水珠。
6. 将上一步所得溶液和絮状沉淀都加入一个吸附柱CB3中(吸附柱放入收集管中), 12,000 rpm (~13,400×g ) 离心30 sec,倒掉废液,将吸附柱CB3放入收集管中。
7. 向吸附柱CB3中加入500 μl缓冲液GD,12,000 rpm (~13,400×g ) 离心30 sec,倒掉废液,将吸附柱CB3放入收集管中。
8. 向吸附柱CB3中加入600 μl漂洗液PW,12,000 rpm (~13,400×g ) 离心30 sec,倒掉废液,吸附柱CB3放入收集管中。
9. 重复操作步骤8。
10. 将吸附柱CB3放回收集管中,12,000 rpm(~13,400×g)离心2 min,倒掉废液。
将吸附柱 CB3置于室温放置数分钟,以晾干吸附材料中残余的漂洗液。
注意:这一步的目的是将吸附柱中残余的漂洗液去除,漂洗液中的残留会影响后续的酶反应(酶切、PCR等)实验。
11. 将吸附柱CB3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50-200 μl洗脱缓 冲液TE,室温放置2-5 min,12,000 rpm (~13,400×g ) 离心2 min,将溶液收集到离心管 中。
注意:洗脱缓冲液体积不应少于50 μl,体积过小影响回收效率。洗脱液的pH值对于 洗脱效率有较大影响。
若用ddH2O做洗脱液应保证其pH值在7.0-8.5范围内,pH值低 于7.0会降低洗脱效率;且DNA产物应保存在-20℃,以防DNA降解。
为增加基因组 DNA的得率,可将离心得到的溶液再加入吸附柱CB3中,室温放置2 min,12,000 rpm(~13,400×g )离心2 min。
DNA浓度及纯度检测
得到的基因组DNA片段的大小与样品保存时间、操作过程中的剪切力等因素有关。回收得到的DNA片段可用琼脂糖凝胶电泳和紫外分光光度计检测浓度与纯度。 DNA应在OD260处有吸收峰,OD260值为1相当于大约50 μg/ml双链DNA、40 μg/ml 单链DNA。 OD260/OD280比值应为1.7-1.9,如果洗脱时不使用洗脱缓冲液,而使用ddH2O,比值会偏 低,因为pH值和离子存在会影响光吸收值,但并不表示纯度低。