

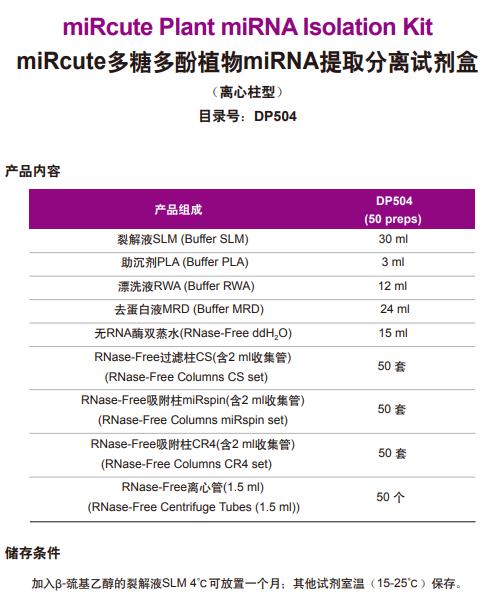
天根miRcute多糖多酚植物miRNA提取分离试剂盒 DP504
产品简介

操作步骤:
使用前在漂洗液RWA和去蛋白液MRD中加入C₂H₆O,加入量请参见瓶上标 签。
一、miRNA富集部分的提取 对miRNA的纯度要求较高时,比如miRNA芯片研究、miRNA克隆建议采用此方法。
1.匀浆处理 50 mg植物叶片或果实果肉在液氮中迅速研磨成粉末,转入到1.5 ml离心管中,加入500 μl裂解液SLM,颠倒混匀以保证裂解液浸没所 有样本,再加入1/10裂解液体积的助沉剂PLA,立即涡旋震荡混匀。
注意 1:对于预期RNA得率小于10 μg的植物样本,请使用100 mg的起始样本量;对于富 含淀粉的样本或成熟叶片,请将裂解液SLM用量增加至700 μl。
注意 2:由于植物多样性非常丰富,而且同种植物的不同生长发育阶段和不同组织RNA含 量都不相同,请根据具体实验情况选择合适的样本量。
2.室温,12,000 rpm(~13,400×g) 离心5 min。
3.将上清液转移至过滤柱CS上(过滤柱CS放在收集管中),室温12,000 rpm(~13,400×g) 离 心2 min,小心吸取收集管中的上清至新的RNase-Free的离心管中,吸头尽量避免接触收 集管中的细胞碎片沉淀。
4. 量取转移液的体积,缓慢加入转移液体积0.43倍的C₂H₆O, 混匀(此时可能会出现沉淀)。将得到的溶液和沉淀一起转入吸附柱 miRspin中,室温 12,000 rpm (~13,400×g)离心30 sec。若一次不能全部加入到吸附柱 miRspin中,请分两次转入,离心后弃掉吸附柱miRspin,保留流出液。
5. 量取流出液的体积,缓慢加入流出液体积0.75倍的C₂H₆O,混匀(此时可能会出现沉淀)。将得到的溶液和沉淀一起转入吸附柱CR4 中,室温 12,000 rpm (~13,400×g)离心30 sec,若一次不能全部加入到吸附柱CR4中, 请分两次转入,离心后弃掉流出液,保留吸附柱CR4。
6. 向吸附柱CR4中加入700 μl去蛋白液MRD,室温静置2 min,室温 12,000 rpm (~13,400×g)离心30 sec,弃废液。
7. 向吸附柱CR4中加入500 μl漂洗液RWA(请先检查是否已加入乙醇),室温静置2 min, 室温 12,000 rpm (~13,400×g)离心30 sec,弃废液。
8. 重复操作步骤7。
9. 将吸附柱CR4放入2 ml收集管中,室温 12,000 rpm (~13,400×g)离心2 min,去除残余液 体。
注意:此步骤目的是将吸附柱中残余的漂洗液去除,离心后将吸附柱CR4在室温放置2 min,或置于超净工作台上通风片刻,以充分晾干。如果有漂洗液残留,可能会影响后续 的RT等实验操作。
10. 将吸附柱CR4转入一个新的RNase-Free 1.5 ml离心管中,加50 μl RNase-Free ddH2O, 室温放置2 min,室温 12,000 rpm (~13,400×g)离心2 min。
注意:洗脱缓冲液体积不应少于30 μl,体积过小影响回收效率。且RNA应保存在-70℃, 以防降解。
注意:如果想提高RNA得率,可重复上步操作一次。
二、 Total RNA的提取 提取的total RNA中含有miRNA等small RNA。
对miRNA的纯度要求不高时,比如在研 究miRNA RT-PCR、miRNA Northern blot时也可以采用此方法。
1. 匀浆处理 50 mg植物叶片或果实果肉在液氮中迅速研磨成粉末,转入到1.5 ml离心管中,加入500 μl裂解液SLM ,颠倒混匀以保证裂解液浸没所有 样本,再加入1/10裂解液体积的助沉剂PLA ,立即涡旋震荡混匀。
注意1:对于预期RNA得率小于10 μg的植物样本,请使用100 mg的起始样本量;对于富 含淀粉的样本或成熟叶片,请将裂解液SLM用量增加至700 μl。
注意2:由于植物多样性非常丰富,而且同种植物的不同生长发育阶段和不同组织的RNA 含量都不相同,请根据具体实验情况选择合适的样本量。
2. 室温,12,000 rpm(~13,400×g) 离心5 min。
3. 将上清液转移至过滤柱CS上(过滤柱CS放在收集管中),12,000 rpm(~13,400×g) 离心2 min,小心吸取收集管中的上清至新的RNase-Free的离心管中,吸头尽量避免接触收集 管中的细胞碎片沉淀。
4.缓慢加入1.5倍上清体积的C₂H₆O,混匀(此时可能会出现沉淀),将得到的溶液和 沉淀一起转入吸附柱CR4中, 12,000 rpm(~13,400×g)离心30 sec,倒掉收集管中的废 液,将吸附柱CR4放回收集管中。
若一次不能全部转入吸附柱CR4 ,请分两步进行。 注意:如果上清液体积有损失,请相应调整无水乙醇的加量。
5.向吸附柱CR4中加入700 μl去蛋白液MRD(使用前请检查是否已加入乙醇),12,000 rpm(~13,400×g)离心30 sec,倒掉收集管中的废液,将吸附柱CR4放回收集管中。