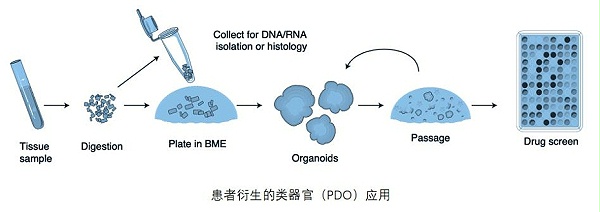
ipsc类器官-类器官PDO服务
| 类器官Organoid / Patient Derived Organoid, PDO
目前研究人员倾向于使用体外模型进行药物筛选和评估。除了避免动物实验的伦理问题,还可以缩短研究周期并降低成本,构建适当的体外模型能准确地反映体内环境,并在此基础上可以准确反映目的药物的药效学和药代动力学。凭借对类器官的深入研究,海星生物一直在追踪前沿的技术创新并将其创造性地应用于其药物开发平台,为我们的客户提供高质量和可靠的研究服务。类器官就是(Organoid)是我们提供体外药理学和安全性评估的重要工具之一。
| 类器官Organoid
类器官是一个三维“微器官模型”,它是通过Self-organization的不同类型的干细胞而制备的,可以模拟天然器官的结构和功能。与传统的二维培养模型相比,类器官可以代表整个生物体的生理过程,具有更接近体内细胞组成和行为,基因组更稳定,更适合生物转染和高通量筛选的优点。与动物模型相比,类器官模型的操作不仅更简单,而且还可以用于研究疾*病发生和发展的机制。
| 患者衍生类器官(Patient Derived Organoid, PDO)
癌症作为对人类健康的大威胁,近年来,已占据了科学家的大部分精力,有效评估抗癌药物的模型是成功开发抗癌药物的重要工作。目前患者衍生的类器官无疑是有前途的研究模型。凭借多年的药物研究服务经验,海星生物建立了先进的患者衍生类器官平台,该平台不仅具有全面的患者衍生类器官库,而且还基于此为您提供广泛的药物评估服务(目前可以提供:肺癌、肠癌、胃癌等模型)。
到目前为止,已经开发了多种以上的PDO模型。表型和基因型分析表明,PDOs与天然肿瘤的特征相似,具有相同的基因突变谱,其预测药物反应性与实际应用一致性大于90%。从形态上讲,PDO也类似于原发性肿瘤。用于肿瘤的免疫组织学标记物表达和免疫组织学标记物也可以在PDO中以相同的模式表达。
因此,单个PDO具有与相应患者相同的组织学和遗传学特征,因此每个PDO都可以作为小型患者试验进行测试,目前广泛用于肿瘤药物的测试。此外,PDO的生产周期短,可确保在药物评估期间有充足的供应,并使患-者能够获得更适合他们的个性化治疗。
| 基于PDO技术积累
到目前为止,已开发了7种的PDO模型。表型和基因型分析表明,PDOs与天然肿瘤的特征相似,具有相同的基因突变谱,其预测药物反应性和非反应性的准确性达到95%。目前主要涵盖的PDO模型包括:
肺癌(15个,基因型涵盖EGFR/ALK/ ROS1/KRAS/BRAF/NTRK),
肠癌(26个,基因型涵盖 KRAS /NRAS/PIK3CA/BRAF ),
肝癌(30个,基因型涵盖BRAF /ROS1 /KRAS /EGFR /RET ),
胰腺癌(8个,基因型涵盖BRCA1/BRAF/KRAS/ EGFR /RET ),
胃癌(12个,基因型涵盖HER-2 /ROS1 /NTRK/ EGFR /RET ),
可以按照客户的需求提供PDOs模型定制和研发服务。
| 类器官模型优势
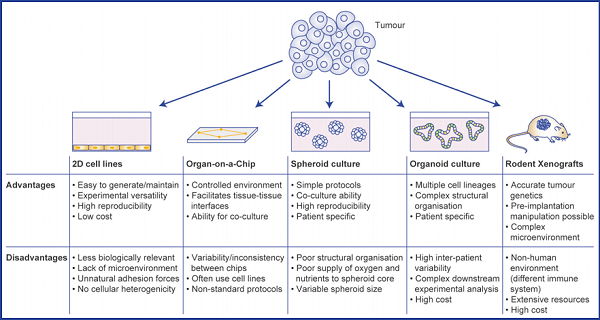
与多种现有肿瘤模型相比,类器官具有多种优势,克服了传统模型的缺点。
♦ 样本直接来源于一线,表征更一致;
♦ 药物实际使用响应高,更具预测性;
♦ 满足高通量筛选,高成功率;
♦ 周期短,可实现从体外到体内;
研究表明,类器官在预测药物临床响应性方面,预测药物有效性阳性率 88% ,预测药物无效或耐药率100%。
PDO直接来源于肿瘤组织,包含原发肿瘤的肿瘤干细胞(CSC),CSC能够自我更新并分化,所以PDO再现了原发肿瘤内的细胞多样性,且能够真实反应其亲代肿瘤的基因组、形态和病理生理学特征。例如,已证明胰腺肿瘤类器官可保持持致癌基因突变,如KRAS、TP53、SMAD、CDKN2A及扩增的MYC等,以及肿瘤抑制基因TGFBR2和DCC的缺失。
| 基于PDO的技术服务:
1. 药物筛选
2. 药物功效测试
3. 体外药代动力学评估
4. 药物毒性测试
5. 抗癌药物发现
目前仅提供肺癌、肠癌、胃癌、肝癌的PDO模型,其他器官的PDO需要定制。
| 已有的PDO模型:
♦ 常见癌种的200+ 例高质量PDO模型库
♦ 按国际标准进行模型的分子鉴定(NGS)和CAP认证的病理检测
♦ 一系列特殊突变和耐药PDO模型:如肠癌类器官KRAS突变、NTRK融合等
♦ 新的PDO模型构建
♦ PDOX肿瘤模型构建
|
PDO模型 |
样本名称 |
基因型 |
|
肠癌类器官 |
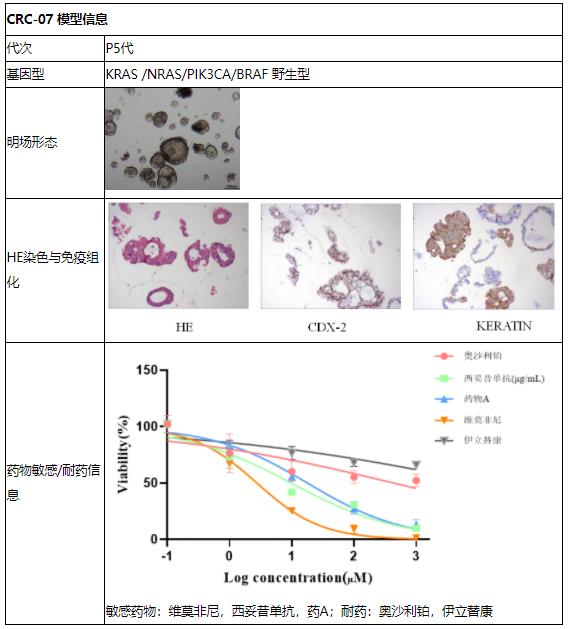
CRC-07 |
KRAS /NRAS/PIK3CA/BRAF 野生型 |
|
CRC-19 |
KRAS(G12D) |
|
|
CRC-26 |
KRAS(G12A),NRAS(Q61R) |
|
|
CRC-39 |
PIK3CA(H1447R) |
|
|
CRC-31 |
KRAS(G13C) |
|
|
肺癌类器官 |
肺癌NO3 |
EFGR(L858R) |
|
肺癌NO6 |
ROS1基因重排 |
|
|
肺癌N07 |
KRAS(G12D) |
|
|
肝癌类器官 |
HCC-16 |
BRAF(V600E) |
|
HCC-28 |
ROS1基因重排 |
|
|
HCC33 |
EFGR(T790M) |
|
|
胃癌类器官 |
胃癌NO1 |
HER-2+ |
|
胃癌NO3 |
EFGR 外显子19缺失 |
|
|
胰腺癌类器官 |
胰腺癌NO2 |
BRCA1突变 |
我们已经建立了用于药物筛选和评估的体内和体外模型库,可以根据此模型提供全面的药物评估服务,请0512-62956104或18934597460进行了解。
| 肿瘤类器官在免疫疗法开发中的优势
体外肿瘤类器官在肿瘤免疫学中增强了肿瘤类器官的临床相关性。异质性的三维结构和空间排列形成了微型器官,可以体现原始肿瘤的基因组、形态和生理特征。有助于为I/O药物产生更准确的疗效和效力数据,确认耐药机制或了解治疗失败的原因,了解模型多样性/异质性。
肿瘤类器官共培养平台的体外特性也使它们比体内模型更具可扩展性,这意味着可以同时测试多个药物和供体/模型组合。另一个优势在于,对应的健康的类器官也可以同时开发,以评估对人体组织的任何潜在的脱靶效应,这在体内模型是不可能实现的。
| 免疫细胞激动双特异抗体类器官模型
双特异性抗体药物上市将为癌者带来巨大的福音。双特异性抗体药物可以结合两个靶向位点,一个是肿瘤细胞表面的肿瘤抗原,另一个是免疫细胞表面的抗原。普通的单抗只能结合单一的抗原,其结合特异性相对较低,容易发生脱靶效应。双特异性抗体药物可以募集和激活免疫细胞,拥有比单抗药物更强大的效果。
| 类器官药物活性检测案例
肠癌类器官T细胞激动双特异抗体A活性实验
周期: 20个工作日
双特异抗体模型测试某药物活性试验展示:
根据客户需求,构建患者肿瘤类器官模型,与该患者外周血来源T-cell共培养,按照类器官+T-cell+CD3双特异型抗体A、类器官+T-cell+Isotype抗体、类器官+CD3双特异型抗体A分别处理,每组三个重复。
试验结果展示:
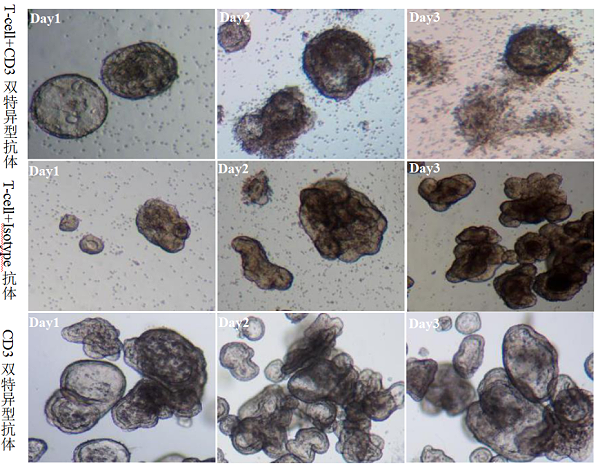
结果显示,类器官+T-cell+CD3双特异型抗体实验组,T-cell被招募与肿瘤类器官结合,并被激活杀伤PDO。表明T-cell-PDO模型能在体外反应双特异抗体的激活杀伤效应。
CRC-07 模型信息展示