

骨髓间充质干细胞在诱导培养基的作用下,会逐渐向软骨细胞方向分化,软骨细胞外具有一层富含蛋白多糖的基质,是成软骨分化的标志物,可被阿利辛蓝染成蓝绿色。
骨髓间充质干细胞成软骨诱导分化培养基适用于骨髓间充质干细胞成软骨诱导,能提高诱导效率。
产品特点:产品性能稳定,可提高骨髓间充质干细胞成软骨诱导效率;
同时适用于骨髓间充质干细胞平面诱导和三维诱导;
含染色液,方便使用;即用型产品,开封即可使用,更省时省力。
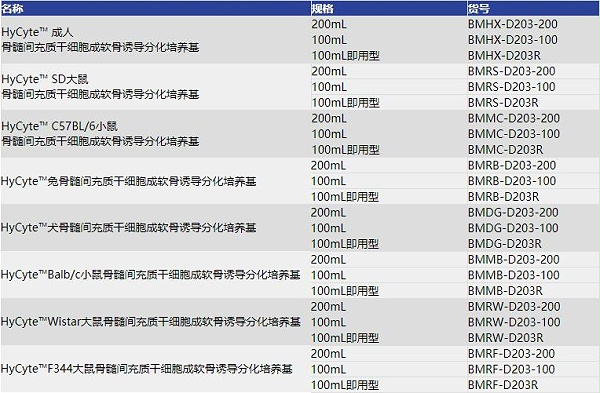
骨髓间充质干细胞成软骨诱导分化培养基
产品简介
骨髓间充质干细胞在诱导培养基的作用下,会逐渐向软骨细胞方向分化,软骨细胞外具有一层富含蛋白多糖的基质,是成软骨分化的标志物,可被阿利辛蓝染成蓝绿色。骨髓间充质干细胞成软骨诱导分化培养基适用于骨髓间充质干细胞成软骨诱导,能提高诱导效率。
骨髓间充质干细胞成软骨诱导分化培养基
产品特点:
(以下步骤仅供参考,详情参见说明书)
1. 间充质干细胞的准备:
将对数生长期的细胞消化下来计数,取3×105个细胞转移到15mL离心管中,250g离心4min。
弃上清,加入0.5mL成软骨诱导分化培养基基础液,重悬细胞,150g离心5min。小心弃去上清,加入0.5mL成软骨诱导分化培养基诱导液,重悬细胞,150g离心5min。
将15mL离心管的管盖稍稍旋开,放置于37℃,5% CO2培养环境下培养。
2. 细胞分化诱导:
24h后观察细胞沉淀形变团聚的情况,如有明显的变化,则小心轻柔地拨动管底,尝试让细胞团脱离管底,全部浸润在诱导液中。
置于37℃,5% CO2培养环境下培养约21天,通常每2天更换一次新鲜配制的成软骨诱导分化培养基诱导液。注意观察细胞团成球情况及表面光滑度,决定终止细胞诱导的时间,并进行染色鉴定。
3. 染色鉴定
a)软骨球固定:将软骨球从离心管中转移至EP管,并使用1×PBS清洗两次,最后置于适量的4%中性甲醛溶液中。
b)石蜡包埋切片:软骨球经石蜡包埋后切片。
c)阿利辛蓝染色:将石蜡切片脱蜡,使用阿利辛蓝染液染色30min,用自来水流水冲洗2min,蒸馏水冲洗1次。
d)诱导评估:显微镜下观察成软骨染色效果,并进行图像采集和诱导评估。诱导成功时,软骨组织中的内酸性粘多糖可被阿利辛蓝染成蓝绿色。
NOTE: 间充质干细胞的成软骨分化水平因细胞类型、细胞供体来源,培养条件、细胞代次、细胞状态和分化时间等因素而异。
| 举例说明:成软骨诱导步骤(平面诱导)
(以下步骤仅供参考,详情参见说明书)
1. 将对数生长期的细胞消化下来计数,成软骨诱导分化培养基细胞重悬细胞,离心后调整细胞密度密度1-2.0×107cells/mL。
2. 20μL悬滴到24孔板中央。(20μL含有4×105细胞)。37℃培养3h使细胞贴壁。
3. 补充200uL诱导分化培养基正常培养,每隔2-3天换液一次。按照以上换液频率诱导21-28天,并注意观察细胞形态变化。
4. 细胞固定:吸去培养基使用适量1×PBS清洗一次,弃去后取适量4%中性甲醛溶液覆盖培养器皿底面,室温固定30-60min,弃去固定液再使用1×PBS清洗两次。
5. 阿利新蓝染色:向清洗干净的诱导孔内加入适量染色液,避光静置染色30min。吸去阿利新蓝染色液,用1×PBS清洗两次,并加入适量1×PBS避免细胞干燥。
6. 诱导评估:显微镜下观察成软骨染色效果,并进行图像采集和诱导评估。诱导成功时,软骨组织中的内酸性粘多糖可被阿利辛蓝染成蓝绿色。
NOTE:间充质干细胞的成软骨分化水平因细胞类型、细胞供体来源,培养条件、细胞代次、细胞状态和分化时间等因素而异。
