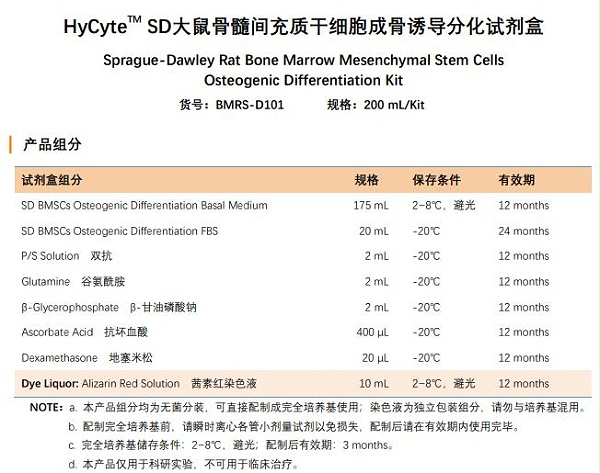
骨髓间充质干细胞成骨诱导分化培养基
英文名称:Bone Marrow Mesenchymal Stem Cells Osteogenic Differentiation Kit
货号:BMRS-D101
规格:200 mL/Kit
质检标准 pH:7.2~7.4
内毒素含量:<10 EU/mL
生物安全:细菌、真菌、支原体检测阴性
质量检测:诱导测试合格
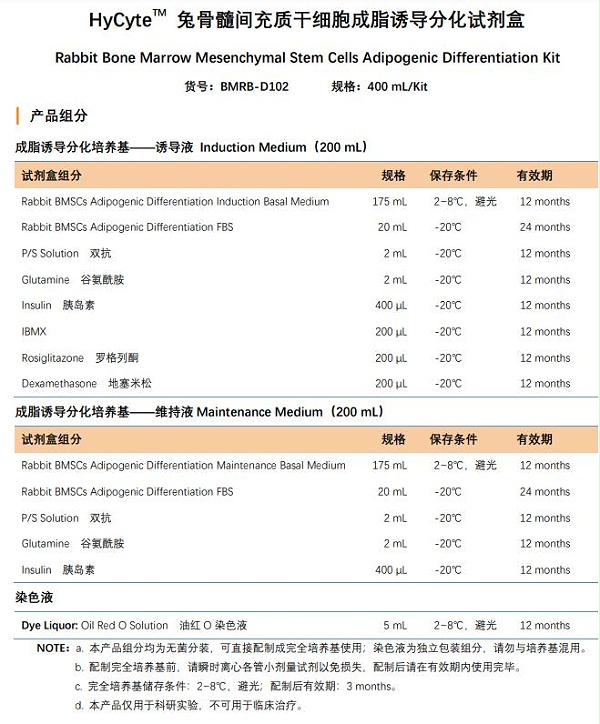
Rabbit Bone Marrow Mesenchymal Stem Cells Adipogenic Differentiation Kit
货号:BMRB-D102
规格:400 mL/Kit
| 使用说明
1. 成脂诱导分化操作
1.1 接种干细胞 取对数生长期的细胞, 按 照 2.0×10e4 cells/cm2 的细胞密度接种至培养器皿,于 37℃, 5% CO2培养环境下培养至汇合度 90~100%,弃掉 上清,加入成脂诱导分化培养基诱导液。
NOTE:如细胞贴壁性较差,建议使用 0.1%明胶对培养底 面进行包被。
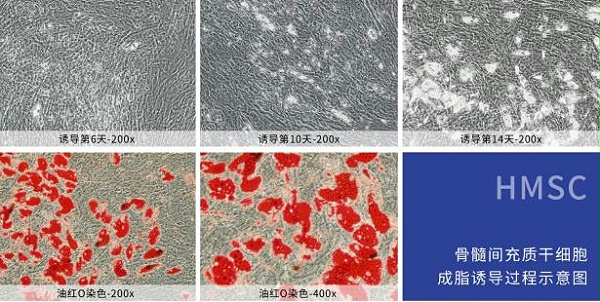
1.2 细胞分化诱导 于 37℃,5% CO2培养环境下培养约 3 天,更 换为成脂诱导分化培养基维持液,培养 1 天后, 再更换为成脂诱导分化培养基诱导液,继续培养 3 天。 按照以上换液频率诱导 14~21 天,并注意观 察细胞形态变化。根据细胞诱导形成的脂滴数量 和大小,决定终止细胞诱导的时间,并进行染色 鉴定。
2. 染色鉴定
2.1 细胞固定 吸去培养基使用适量 1×PBS 清洗一次,弃去 后取适量 4%中性甲醛溶液覆盖培养器皿底面,室 温固定 30~60 min,弃去固定液再使用 1×PBS 清 洗两次。
2.2 油红 O 染色 取生理盐水或1×PBS与油红O原液配制油红 O工作液(油红O原液: 生理盐水=3:2),现用现 配。配制后可对油红O工作液进行离心,以沉淀 染色液中的过饱和析出物。向清洗干净的诱导孔 内加入适量油红O工作液,静置染色30min。吸走 油红O工作液,用1×PBS清洗两次,并加入适量1 ×PBS避免细胞干燥。
2.3 诱导评估 显微镜下观察成脂染色效果,并进行图像采 集和诱导评估。诱导成功时,脂滴与油红 O 染料 结合后呈现红色或橘红色。 NOTE: 干细胞的成脂分化水平因细胞类型、细胞供体来 源,培养条件、细胞代次、细胞状态和分化时间等因素而异。