

单细胞技术主要研究内容主要有:单细胞运动,单细胞生化活性,细胞牵引力等,单细胞技术研究方法有哪些?下面小编带你一起来探寻。
细胞迁移运动的研究方法
细胞迁移在许多动态过程中至关重要,例如血管生成、胚胎发育、伤口愈合和疾病进展。如前所述,当前的大部分知识体系都是从总体研究中产生的。然而,就细胞运动而言,只有选定的细胞才能进行自由运动,并且通常由单个细胞引导,充当向导。还表明,单细胞迁移模拟 3D 环境中的细胞运动。
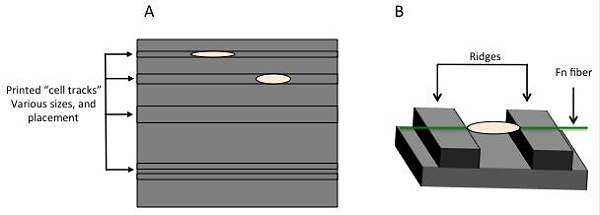
图 1. 1D 单细胞迁移研究使用微接触印刷轨道让细胞附着并沿其移动 (A)。另一种方法是悬浮单根纤维状纤连蛋白(任何纤维状基质蛋白都可以),为细胞附着和迁移创造一个伪 3D 环境 (B)。
有几种方法可以研究单细胞迁移。一种流行的方法是使用微接触印刷区域来创建“细胞轨迹”。这种方法可以轻松探索迁移的几何限制。印刷区域可以具有多种形状和图案,以严格控制和探索广泛的条件(图 1A)。1D 轨迹研究已经完成,表明细胞呈现出与天然 3D 基质中的细胞非常相似的独特形态和表型。为了充分探索这一现象,研究人员通过显微打印创建了不同厚度的“轨迹”,然后涂上基质蛋白纤连蛋白 (Fn) 。这一观察结果在其他研究中得到了概括,包括在伪 3D 环境中对 Fn 的单纤维进行的研究(图 1B)。单纤维研究利用内皮细胞,并证明了不同机械应变纤维的明显细胞附着和迁移差异。尖端细胞遵循 Fn 初步矩阵在血管生成和血管生成中创建血管系统。在伤口愈合、疾病进展和发展的动态过程中,接受营养和其他关键生物成分的能力是必不可少的。 在单细胞迁移中的这一发现提出了与所有这些过程相关的定向迁移理论,以及由于 Fn中的配体密度而对 durotaxis 的机械洞察力。
通过利用微流体平台运行不同种类的单细胞迁移测定。创建通道系统,细胞被困在某些区域,然后允许迁移穿过一部分。这些系统不仅过滤细胞,还允许迁移检查。已经在该系统内进行了癌症研究,以确定癌细胞迁移能力的差异,以检查转移的根本原因。此外,该系统还有一个额外的好处,即能够探索定向迁移,例如趋化性,还可以进一步检查具有迁移能力的细胞,以发现其他关键差异。已经表明,与非转移细胞相比,转移细胞对趋化梯度的反应更大,并且显示出较更高水平的 GTP 酶标记物。
跟踪细胞迁移的传统方法也可以应用于单个细胞。单细胞迁移的关键因素是起初减少细胞与细胞的接触。这可以通过将低密度的细胞电镀到涂层表面来实现的。选择用于涂覆表面的分子取决于研究参数,就像体迁移研究一样。由于细胞倾向于粘附,因此必须进行彻底的筛选过程,以确保选定的迁移细胞具有相关且具有代表性的表型。
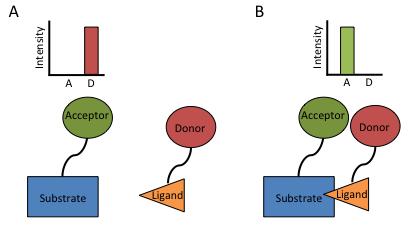
图 2. FRET 生物传感器通过将供体和受体荧光团连接到感兴趣的分子来发挥作用。当分子相互作用并且供体足够接近以激发受体荧光团时,就会发生 FRET。这导致强度信号从完全供体转变为完全受体。
单细胞技术中的3D 迁移是一种较容易采用的技术,因为它结合了单细胞分析的特点,同时将细胞置于与其原生环境非常相似的环境中。胶原蛋白 3D 基质现在可以在大多数实验室中轻松生产,这使得这些研究比以前在基质凝胶上进行的研究较容易获得。尽管 2D 和 3D 迁移之间的运动有相似之处,但正在生成更全面的细胞运动图像。细胞通过肌动蛋白聚合在 2D 中迁移,从而产生具有片状伪足的前沿和滞后边缘。然而,在 3D 中,有几种迁移模式取决于前缘形状和细胞-基质粘附。此外,即使在 3D 中,细胞也会继续对基质的机械特性做出反应。2D 和 3D 迁移之间有明显的相似之处,但环境更加复杂和动态,导致迁移趋势多种多样。3D 迁移的比较大的挑战之一是使用显微镜可视化该过程以收集相关数据,但先进的成像技术和计算机算法使其成为可能。
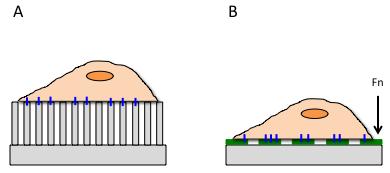
图 3.细胞牵引力通过细胞附着和变形支柱 (A) 或 Fn 涂层水凝胶 (B) 来计算。
生化活性测定
在单细胞技术水平研究生物过程可以扩展许多以前的知识库,方法是识别通常通过分析大量大细胞群而模糊的关键差异。然而,单细胞技术也适用于研究导致和驱动这些过程的根生化活动。Forester 或荧光共振能量转移 (FRET) 是能量从供体到受体荧光团的无辐射转移 。转移依赖于邻近性,并且仅当两个相应的荧光团相距 1 到 10 纳米时才会发生。在这些距离内,激发(供体)荧光团发射一个虚拟质子,该质子被接收(受体)荧光团吸收,引起相应的激发。因此,结果被解释为受体荧光的函数(图 2)。FRET 允许对远低于传统显微镜分辨率的生物现象进行可视化 。多种分子可以与供体和受体荧光团结合,使 FRET 能够探测许多生物过程。FRET 已成功用于探测蛋白质折叠和构象、DNA-DNA/RNA 相互作用、蛋白质-蛋白质相互作用和配体-受体结合 。FRET 系统通常被称为生物传感器,除了能够独立生产新的传感器之外,现在还可以直接通过商业的方式获得。
生物传感器用于较多地了解 GTP 酶的作用。使用多个 FRET 传感器产生了传统生化方法无法获得的时空 GTPase 活性数据。通过这些信息可以了解迁移以及与 GTPase Rho、Rac 和 Cyc42 的关系。已确定 Rac 对细胞迁移初始阶段前沿的细胞伸长比较重要,而 Rho 和 Cyc42 对滞后端的回缩也重要。
细胞牵引力的测定
细胞牵引力 (CTF) 是许多生物过程(如迁移)的驱动力。作为细胞运动的调节剂,它们在血管生成和血管发生、发育、伤口愈合和疾病进展等动态过程中有着重要作用。细胞产生的机械力也有助于通过涉及机械信号的反馈回路调节细胞形状和体内平衡。细胞通过附着点产生牵引力到称为粘着斑的细胞外基质。当施加力时,它会导致 ECM 发生变化,通过这种粘附感测到,并导致细胞发生相应的变化。细胞也可以通过这些力相互作用。
CTF 的测量需要三个步骤:打印力阵列、零力阵列测量和施力阵列测量。CTF 测量的主要方法是将小柱打印到柔性聚丙烯酰胺凝胶 (PG) 上,并用细胞外基质蛋白涂覆它们以形成粘着斑 (图 3A)。这些支柱起到悬臂的作用,变形或弯曲它们所需的力可以通过支柱的已知物理特征来计算。支柱的参数和它们印刷的图案是根据相关应用确定的。参数的变化已被用于确定粘着斑数量对 CTF的影响。
细胞外基质蛋白可以直接打印到灵活的 PG 表面(图 3B)。与柱子一样控制间距和图案。该系统的优点是可以以不同的分布和模式打印多种蛋白质,以探索基于粘附基材的 CTF 的差异。这种方法已经证明,细胞迁移与 Fn 形成粘着斑,而不是白蛋白或层粘连蛋白。此外,这项技术还提供了 CTF 的实时分析,并可以同时确定电池的机械性能。
CTF 提供了对粘附和迁移过程的机械洞察。内皮细胞 CTF 的研究证实了细胞迁移的滞后模型,并且还表明细胞运动取决于细胞附着点的密度。形态也受到细胞粘附和 CTF 的影响,导致细胞呈现出与粘着斑数相关的不同表型。对细胞迁移机制的透彻理解主要应用于伤口愈合、转移和细胞发育研究中。
更多 单细胞技术,单细胞生物,单细胞测序技术,单细胞,干细胞技术,流式细胞技术,单细胞分析等相关问题,可以进入 苏州阿尔法生物网站了解,0512-62956104或18934597460.