

SDS-PAGE即:十二烷基硫酸钠-聚丙烯酰胺凝胶电泳技术是一种根据凝胶电泳蛋白质的分子量进行蛋白分离的常用技术。
SDS-PAGE 的实验原理
我们知道,任何带电物质在电场中的运动取决于其净电荷、分子半径和外加场的大小。但是天然折叠蛋白质的的不同之处在于它们的净电荷和分子半径都与分子量无关。蛋白的净电荷取决于蛋白质中正负氨基酸的总和以及蛋白质三级结构的分子半径。
因此,在天然状态下,具有相同分子量的不同蛋白质会根据其电荷和 3D 形状在电场中以不同的速度迁移。SDS-PAGE电泳技术需要做的是将蛋白质还原为线性分子来破坏三级结构,并以某种方式来掩盖蛋白质的内在净电荷,从而根据蛋白质的分子量进行蛋白区分。
所以,SDS-PAGE 的工作原理的实质是根据蛋白质在施加电场的影响下通过筛分基质(凝胶)的不同迁移率,根据蛋白质的分子量来分离蛋白质。

SDS在 SDS-PAGE 中的作用
SDS 是一种存在于 SDS-PAGE 样品缓冲液中的去污剂,其中有一点沸腾,还有一种还原剂(通常是 DTT 或ββ-ME 分解蛋白质-蛋白质二硫键),它会破坏蛋白质的三级结构。这使折叠的蛋白质变成线性分子。
SDS 还用均匀的负电荷覆盖蛋白质,从而掩盖了 R 基团上的固有电荷。SDS 与线性蛋白质的结合相当均匀(大约 1.4g SDS/1g 蛋白质),SDS 也存在于凝胶中,以确保一旦蛋白质被线性化并掩盖了它们的电荷,它们在整个运行过程中都保持这种状态。
决定 SDS 包被蛋白质迁移率的主要因素是其分子半径。SDS 包被的蛋白质已被证明是线性分子,宽 18 埃,其长度与其分子量成正比关系,所以分子半径是由蛋白质的分子量的大小索决定。
凝胶基质在 SDS-PAGE 中的作用
在施加的电场中,经过 SDS 处理的蛋白质现在将根据其分子量以不同的速率向正极移动。由于凝胶基质的高摩擦环境,这些不同的流动性将被夸大。
由于聚丙烯酰胺具有化学惰性,而且它可以很容易地制成各种浓度以产生不同的孔径,从而提供适合各种分离的条件,因此常用它作为SDS-PAGE的凝胶基质。
不连续缓冲系统解释
为了通过凝胶将电流从阴极(负)传导到阳极(正),显然需要缓冲液。大多数使用不连续的Laemmli 缓冲系统。“不连续”只是意味着凝胶和罐中的缓冲液不同。
通常,系统设置有 pH 6.8 的浓缩凝胶、Tris-HCl 缓冲、Tris-HCl 缓冲至 pH 8.8 的运行凝胶和 pH 8.3 的电极缓冲液。浓缩胶的丙烯酰胺浓度较低,因为我们不希望蛋白质在这里分离,而流动胶的丙烯酰胺浓度较高,能够阻止蛋白质的运动。

SDS-PAGE 的工作原理
1.堆积胶在 SDS-PAGE 中的作用
当电源打开时,pH 8.3 电极缓冲液中带负电荷的甘氨酸离子被迫进入浓缩胶,此处的 pH 值为 6.8 。在这种环境下,甘氨酸主要转变为两性离子(带中性电荷)状态。这种电荷损失导致甘氨酸离子在电场中移动非常缓慢。
Cl- 与 Tris 反离子(现在向阳极移动)的分离产生了一个带有陡峭电压梯度的狭窄区域,将甘氨酸离子拉到它后面,导致迁移离子的两个狭窄分离的前沿;高度流动的 Cl- 前沿,其次是较慢的,主要是中性甘氨酸前沿。
凝胶样品中的所有蛋白质的电泳迁移率介于甘氨酸和 Cl- 迁移率的极值之间,因此当两个前沿扫过样品孔时,蛋白质会集中到 Cl 之间的狭窄区域 - 和甘氨酸前沿。
当蛋白质迁移时遇到运行的凝胶时,在那里 pH 值切换到 8.8。在此 pH 值下,甘氨酸分子大多带负电荷,迁移速度比蛋白质快得多,此时,分子量的大小决定了其迁移的速度,逐渐实现分离。
蛋白分离
一旦蛋白质进入电泳凝胶,它们就会分离,因为较高分子量的蛋白质通过多孔丙烯酰胺凝胶的速度比较低分子量的蛋白质更慢。通过改变丙烯酰胺浓度,可以根据要分离的蛋白质的大小来改变凝胶中孔的大小。
典型值显示在下表 1 中。
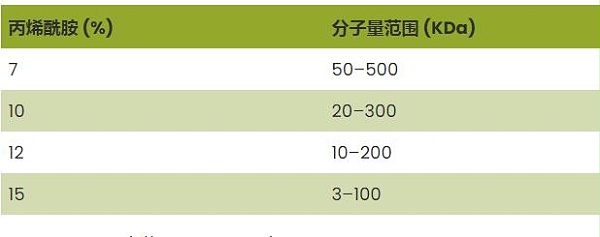
在SDS-PAGE中 ,对于更广泛的分离范围,或难以分离的蛋白质,可以使用具有不断增加丙烯酰胺浓度的层的梯度凝胶。
【本文来源于网络,如有侵权可联系作者删除】 更多SDS-PAGE相关问题请拨打0512-62956104咨询。