

细胞转染法中的化学转染法主要三种,即:磷酸钙法、阳离子脂质体法、DEAE- 右旋糖苷法。其中Lipofectamine 2000、Lipofectamine 3 000 、Lipofectamine 6000等作为阳离子 脂质体转染法常用的转染试剂 在做转染实验时几乎都用过,但是对于Lip2000 转染试剂,你了解多少?这三种转染试剂有什么区别?
一、Lip 2000转染试剂的特征
Lipofectamine 2000转染试剂主要有以下几个特点:
1. 操作过程简单:使用lip转染试剂进行DNA转染时,可以直接将DNA与阳离子脂质体混合和加入培养基中,而且不论是瞬时转染还是稳定转染都能用。在转染时不需要清除血清。
2. Lip转染试剂的适用性较为广,并且转染效率较高,重复性较好,比如:升级后的lip3000可以重复转染。如果使用DEAE-右旋糖苷法进行细胞转染,虽然操作步骤相对简便、结果也能实现可重复,但该转染法对细胞的毒副作用较大,也只能用在瞬时转染中,并且在转染过程中还需要去除血清。使用脂质体转染法的转染效果一般会随细胞类型的不同而出现不同程度的差异。
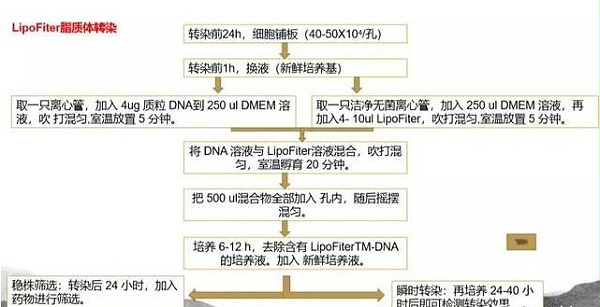
二、Lip2000转染步骤
1.转染前24小时,可以用40*50*104 细胞/孔进行细胞铺板。
2.转染前1小时左右更换新鲜的培养基。在离心管中加入质粒DNA4ug和250uL的DMEM溶液中混合均匀,并在室温下放置5分钟左右。
3.取无菌的离心管加入250UL的DMEM培养基,再加入5-10UL的LIP2000转染试剂混匀后,室温放置5分钟。注意放置时间不宜过长,以免降低细胞的活性。
4.将混合稀释后的DNA与混合稀释后的Lip2000,混合均匀置于室温中孵育20min。混合过程中有可能溶液会变浑浊,不过一般不会影响到转染效率。
5.将孵育后的复合物均匀地加入到培养板中,轻轻托起并摇匀。在37℃,5%的二氧化碳培养环境中再次孵育6-12小时,更换新鲜的培养基。
6.瞬时转染:接着上述步骤再培养24-48小时后,即可使用细胞显微成像系统对细胞进行细胞活性检测,分析转染结果。
7.稳定转染:如果是稳定转染则需要在孵育24H后,加入抗生素类试剂进行稳定细胞株的筛选,这样的稳定表达过程一般需要数天或几周的时间。
三、Lip2000转染试剂的适用范围:
Lip 2000的使用范围较广,它不仅可以用于质粒DNA转染、siRNA表达载体、 双链核糖核酸dsRNA转染, 以及RNA等核酸转染,还可以用于文库筛选的高通量转染。对于细胞转染Lip 2000几乎涵盖了HEK293、CHO细胞等190多种细胞系。
四、Lip2000转染试剂的用量及注意事项:
按照LIP2000说明书,正常情况下使用24孔板进行转染实验,使用量为2ul/次,也就是说一支1.5ml Lip 2000大该可以使用将近700余次。
在使用LIP2000时还需要注意一下几点:
1. 由于LIP2000对细胞的毒性较弱,但仍具有细胞毒性,所以进行细胞铺板时,细胞的普板密度需要达到90%以上,这样可以减少转染试剂的细胞毒性造成的细胞损耗。当然,如果要保证细胞成活率,条件允许可以使用LIP3000或lip6000的无细胞毒性的试剂进行转染。
2.在进行DNA转染过程为获得较高的转染效率,可以进行转染优化实验,在优化实验中,可以通过调整DNA浓度和转染试剂量来测试实现。
3.LIP2000阳离子脂质体的保存温度为4度冷藏保存,切勿冷冻保存。过低的温度容易破坏脂质体内部结构,从而造成转染效率低,甚至无法转染、转染失败等现象。储存过程中也尽量避免长时间开盖,以避免脂质体氧化对转染效率的影响。
苏州阿尔法生物实验器材有限公司13年专注于生物实验室仪器设备和试剂耗材供应,供应的细胞生物学类试剂耗材耗材主要包括细胞培养试剂、培养基、PBS缓冲液、培养瓶、细胞摇瓶、细胞转染试剂、Lip2000、LIP3000等。更多转染试剂分类问题可以 0512 -62956104或18934597460联系。