

文章标签:组氨酸 缓冲液 咪唑 亲和层析 蛋白质纯化
重组蛋白的表达和随后的蛋白质纯化被广泛用于生化研究。其中一些蛋白纯化方法涉及使用肽亲和标签,这些标签与目的蛋白质融合,并用于通过亲和层析加速蛋白质纯化。金属亲和层析法IMAC就是一种常用的蛋白纯化方法,它可用于快速纯化多组氨酸亲和标签蛋白,在一个纯化步骤中可实现 100 倍的富集。 IMAC甚至可以以高产率获得高达 95% 的亲和标签蛋白纯度。
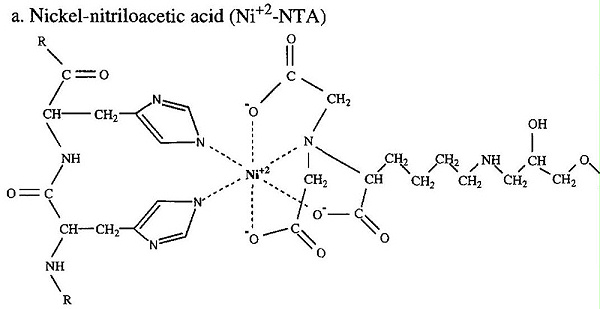
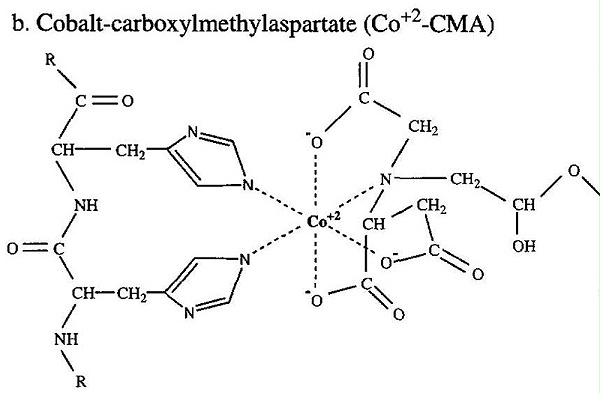
IMAC法的实质是利用固定化金属亲和层析 (IMAC) 来纯化含有由多组氨酸残基组成的短亲和标签的重组蛋白。IMAC 基于过渡金属离子(Co 2+、Ni 2+、Cu 2+、Zn 2+) 固定在基质和特定氨基酸侧链上。组氨酸是与固定化金属离子基质相互作用最强的氨基酸,因为组氨酸咪唑环上的电子供体基团很容易与固定化过渡金属形成配位键。包含连续组氨酸残基序列的肽可有效保留在 IMAC 柱基质上。洗涤基质材料后,可以通过调节柱缓冲液的 pH 值或向柱缓冲液中添加游离咪唑,轻松洗脱含有多组氨酸序列的肽。
一、蛋白质结合、洗涤和洗脱步骤的设计
多组氨酸标签蛋白的结合可以使用柱或分批程序进行。细胞裂解应在调节至 pH 8.0 的缓冲溶液中进行。当使用柱程序时,将树脂填充到柱中,并将细胞裂解物缓慢加载(每小时 3 到 4 柱体积)到柱上。分批程序包括在细胞裂解液中孵育亲和基质树脂,然后将树脂装入柱中。在 4° 孵育期间,可通过摇晃或搅拌将树脂悬浮在细胞裂解液中。使用分批程序通常会导致更有效的标记蛋白结合。无论使用哪种方法,都建议使用最少量的树脂来结合标记的蛋白质。与非特异性结合树脂的其他蛋白质相比,标记的蛋白质通常具有更高的结合亲和力。因此,当使用少量树脂时,标记的蛋白质将填充大部分可用的结合位点,从而减少结合的非特异性蛋白质的数量。氯化钠(最长 500 mM ) 和低水平的咪唑(最高 20 m M)也可以包含在结合缓冲液中,以减少与树脂非特异性结合的蛋白质数量。
除金属螯合剂(如 EDTA)外,大多数蛋白酶抑制剂都可以包含在所有缓冲液中。金属螯合亲和层析,又称固定化金属离子亲和层析。该方法主要利用蛋白质表面的一些氨基酸,如组氨酸、色氨酸、半胱氨酸等能和金属离子发生特殊的相互作用,形成稳定的螯合物从而进行分离。主要以配位键结合为主。
由于金属螯合亲和层析具有配体简单、吸附量大、分离条件温和、通用性强等特点,已成为重组蛋白质的分离纯化的一个重要工具。可以用于各种表达来源(如大肠杆菌、酵母、昆虫细胞和哺乳动物细胞)的组氨酸标签蛋白质纯化。金属螯合亲和层析法主要使用的实验材料包括:Ni IDA Beads, Ni IDA Beads 6FF,Ni NTA Beads,Ni NTA Beads重力柱, HisPur Ni NTA Kit,Ni NTA Beads 6FF,Ni NTA Beads 6FF重力柱, HisCap 6FF,Ni Smart Beads,Ni Smart Beads 重力柱, Ni Smart Beads 6FF,Ni Smart Beads 6FF 重力柱, HisCap Smart 6FF等.
结合标记的蛋白质后,可以洗涤柱子以去除与柱子弱结合的非特异性蛋白质。如果需要,在洗涤缓冲液中加入咪唑(Ni 2+ –NTA 为 10–50 m M,Co 2+ –CMA 为10 m M)将增加洗涤的严格性并有效地洗脱非特异性结合的蛋白质。或者,可以使用 pH 值低于结合缓冲液(Ni 2+ –NTA 的 pH 为 6.3,Co 2+ –CMA 的 pH 为 7.0)的洗涤缓冲液去除非特异性结合的蛋白质。洗涤剂、2-巯基乙醇和氯化钠等试剂通常包含在洗涤和结合缓冲液中,以减少非特异性蛋白质结合。
洗脱目的标记蛋白主要有三种方式。降低 pH 值(Ni 2+ -NTA 为 5.3-4.5 ,Co 2+ -CMA为6.0)使组氨酸残基的咪唑氮原子质子化(p Ka 6.0)并破坏组氨酸和过渡金属之间的配位键. 组氨酸类似物咪唑也可用于竞争性洗脱结合的多组氨酸残基(Ni 2+ –NTA浓度为 100 m M或更高,Co 2+浓度为 50 m M或更高–CMA)。如果标记的蛋白质形成寡聚体,则可能需要更严格的条件,例如低的 pH 值或高浓度的咪唑来洗脱蛋白质。虽然这两种洗脱方法都有效,但多数会使用咪唑,因为暴露于低 pH 值可能会损坏目标蛋白质。但请注意,在 SDS-PAGE 之前将含有咪唑的样品加热至沸腾会导致酸不稳定键水解。相反,建议在分析前将样品在 SDS 上样缓冲液中加热至不超过 37° 并保持 5 分钟。包括螯合剂,例如 EDTA (100 m M) 在洗脱缓冲液中,可以促进蛋白质从树脂中的洗脱。这种处理会将金属原子从基质中剥离出来,从而导致洗脱液受到污染。洗脱液中螯合剂或金属的存在也可能会干扰酶活性。此外,在使用螯合剂后,如果不重新充电,则不能重复使用该基质。
二、可溶性多组氨酸标签蛋白的天然纯化方案
该实验方案设计原理是在非变性条件下使用 Ni 2+ -NTA 树脂从大肠杆菌中纯化带有六个 N 末端组氨酸残基的可溶性 ERK2 蛋白。虽然这种方案可能需要对其他多组氨酸标签蛋白进行轻微的优化,但它是作为纯化天然状态下可溶性蛋白的起点。实验过程中,可以将尿素或盐酸胍添加到缓冲液中,以在变性条件下执行纯化。也可以在缓冲液中添加其他试剂,包括去污剂、2-巯基乙醇和各种蛋白酶抑制剂,也可以添加到缓冲液中以防止非特异性结合或蛋白水解。
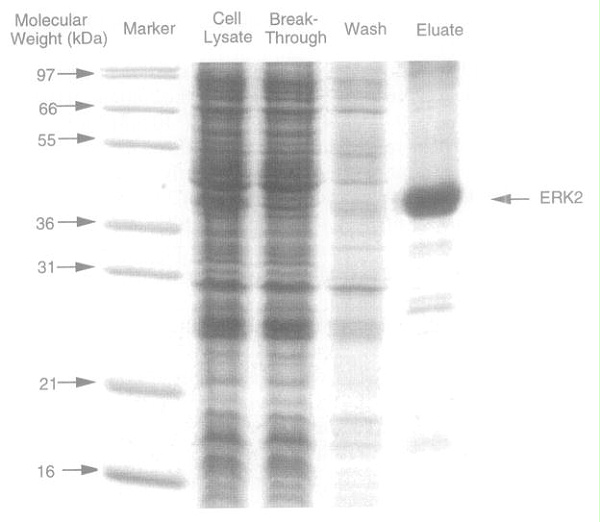
使用镍-次氮基三乙酸 (Ni 2+ -NTA) 基质对具有代表性的多组氨酸标签蛋白纯化进行 SDS-PAGE 分析。图中显示了等体积的细胞裂解物、在分批步骤中未能与树脂结合的穿透材料、将树脂装入柱子后获得的洗涤材料以及柱子的洗脱液。通过考马斯染色使 15% Laemmli 凝胶可视化。
蛋白质纯化步骤如下:
1.通过在加载缓冲液(300 m M NaCl、50 m M NaH 2 PO 4、pH 至 8.0 用 NaOH)中的冰上超声处理来裂解表达标记蛋白的细胞。每克细胞应使用大约 3–5 ml 上样缓冲液。尽可能保持裂解液低温,以尽量减少可能的蛋白水解。
2.通过在 4° 下以 30,000 g旋转 30 分钟立即离心裂解物。
3.将在冰冷加载缓冲液中预平衡的50% Ni 2+ -NTA 浆液 (Qiagen) 添加到上清液中。加入足量的 50% Ni 2+ -NTA 浆液以结合多组氨酸标签蛋白(5–10 mg/ml 树脂)。以 4° 搅拌或旋转 1 小时。
4将树脂加载到柱子上。用 20 柱体积的 4° 上样缓冲液清洗树脂。
5.在 4°下用 20 柱体积的洗涤缓冲液洗涤树脂(与上样缓冲液相同,但也含有 10 m M咪唑,pH 至 8.0 与 HCl)。
6. 在上样缓冲液中使用 20 柱体积梯度 10 至 250 m M咪唑进行洗脱(pH 至 8.0,使用 HCl)。收集 1-ml 级分并使用 SDS-PAGE 分析含有所需蛋白质的级分并汇总。
苏州阿尔法生物提供的 组氨酸标签蛋白亲和纯化介质金属螯合亲和层析法的蛋白质纯化 实验中,另外提供GST-tag蛋白亲和纯化介质, MBP-tag蛋白亲和纯化介质,生物素Biotin-tag蛋白亲和纯化介质,Strep-tagll标签亲和纯化介质, 标签抗体亲和纯化介质,离子交换层析介质,疏水层析介质, 磁性微球,琼脂糖凝胶过滤介质,葡聚糖凝胶过滤介质等蛋白纯化介质填料。0512-62956104或18934597460.