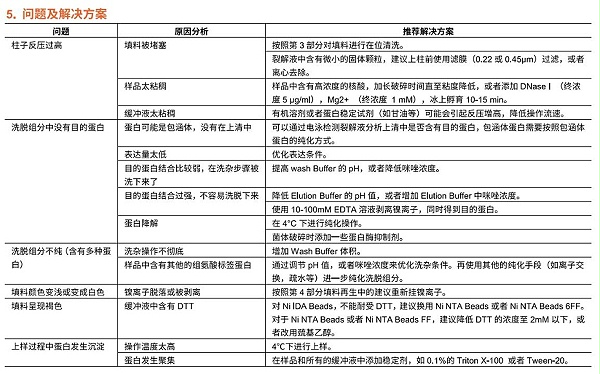
组氨酸标签蛋白亲和纯化介质 Ni IDA Beads介绍
Ni IDA Beads可以用于各种表达来源(如大肠杆菌、酵母、昆虫细胞和哺乳动物细胞)的组氨酸标签(6xHis-tagged)蛋白的纯化。它是以4%琼脂糖凝胶为基质,通过化学方法偶联了三配位的亚氨基二乙酸(IDA),螯合镍离子(Ni2+)后,可以形成比较稳定的平面四边形结构,从而有更多的位点与组氨酸标签上的咪唑环继续配位,达到结合目的蛋白的效果。但是,这样的结构比较容易受到其他小分子的进攻,镍离子易被还原或者被螯合,从而破坏其化学结构,无法结合目的蛋白。Ni IDA Beads具有载量高,性能和价值匹配等优点。
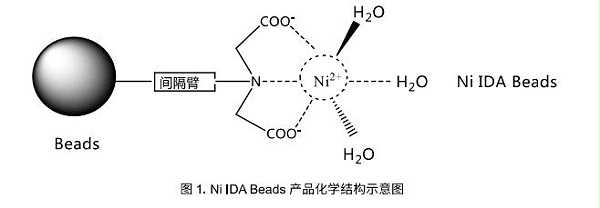
表1. Ni IDA Beads产品性能
|
项目 |
性能 |
|
基质 |
4%琼脂糖凝胶 |
|
载量(/mL基质) |
>40mg 6XHis-tagged protein |
|
微球粒径(μm) |
45–165 |
|
最大压力 |
0.1 MPa, 1 bar |
|
储存缓冲液 |
含20% 乙醇的1XPBS |
|
储存温度 |
4°C-30°C |
2.纯化流程
2.1 缓冲液的准备
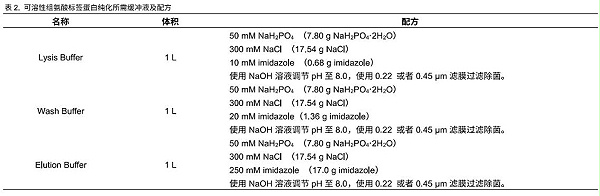
可使用下列推荐缓冲液,也可根据自己的使用习惯配置不同的缓冲液体系,基本原理就是低咪唑上样,高咪唑洗脱。缓冲液在使用前尽量用0.22 μm 或者0.45 μm 滤膜过滤除菌。具体配置方法见表2。
2.2纯化流程
2.2.1 细菌或酵母表达的蛋白
1)挑取单菌落到培养基中,根据载体使用说明,加入相应浓度的诱导剂诱导相应的时间。
2)表达结束后,将培养液转移到离心杯中,7,000 rpm(7,500×g),离心15min 收集菌体,然后按照菌体∶Lysis Buffer=1∶10(WNV)加入
Lysis Buffer,加入终浓度为 1mM的 PMSF。加入溶菌酶(工作浓度为 0.2-0.4 mg/ml,如果表达的宿主细胞内含 pLysS 或 pLysE,可以不加溶菌酶),同时也可加入其他蛋白酶抑制剂,但不能影响目的蛋白与树脂的结合)。
3)将菌体沉淀悬浮起来,(如果菌液浓度高,也可考虑加入10 ug/ml RNase A和5 μg/ml DNase I),混匀,放置于冰上,然后冰上超声破
碎细胞,至菌液基本保持澄清。
4)将澄清的破碎液转移至离心管中,10,000 rpm(15,000×g),4℃离心 20-30 min。取上清,置于冰上备用或-20℃保存。
2.2.2 酵母、昆虫和哺乳细胞分泌表达可溶性蛋白
1)将细胞培养液转移至离心杯,5.000 rpm(3.800×g);离心10min,收集菌体得上清,如上清中不含 EDTA、组氨酸和还原剂等物质,即可直接加入柱子使用;如含有 EDTA、组氨酸和还原剂等物质,需用Lysis Buffer 透析才能加入柱子。2)对于大量体积的上清,需加入硫酸铵沉淀浓缩后,蛋白还需用 Lysis Buffer 透析后才能加入柱子。
2.3 Ni IDA Beads 重力柱的装填
1)取合适规格的重力层析柱,装入下垫片,加入适量纯水润洗柱管和垫片,关闭下出口。
2)将 Ni IDA Beads 混合均匀,用枪头吸取适量浆液加入至重力柱中(介质实际体积占悬液的一半),打开下出口流干保护液。
3)加入适量纯水冲洗介质,待柱管中液体重力流干后,关闭下出口。
4)装入润洗后的上垫片,确保垫片与填料之前没有空隙,且保持水平。
5)装填好的重力柱可以直接加入平衡液进行平衡,暂不使用时则加入保护液,4-30℃保存。
2.4 样品纯化流程
2.4.1 孵育法纯化
1)根据纯化的样品量,取适量 Ni IDA Beads加入离心管中,1000 rpm 离心 1min,吸弃上清;也可加入重力柱中,流干保护液。2)向离心管中加入5倍介质体积的Lysis Buffer 清洗介质,1000 rpm 离心1min,吸弃上清;如使用重力柱,则直接在重力柱中清洗,直接重力流干Lysis Buffer;重复两次以上。
3)加入样品,封闭离心管或重力柱管,4℃振荡孵育2-4 h 或者37℃孵育30 min-2 h。
4)孵育结束后,1000 rpm 离心1 min,吸弃上清,或过滤收集介质,上清保留作为流穿,用于电泳鉴定。
5)用5倍介质体积的Wash Buffer 清洗介质,1000 rpm 离心 1min 或重力柱管过滤,去除上清(注意不要吸到介质),重复3-5次,中间建议更换新离心管。必要时可以调整咪唑的浓度进行洗杂。
6)加入3-5倍柱体积的 Elution Buffer 进行洗脱,室温孵育10-15 min,1000 rpm 离心1min 或重力柱管收集洗脱液,可重复2-3次。
2.4.2 重力柱法纯化
1)将装填好的 Ni IDA Beads 重力柱用5倍柱体积 Lysis Buffer 进行平衡,使填料处于与目的蛋白相同的缓冲液体系下,重复 2-3次。
2)将样品加到平衡好的重力柱中,样品保留时间至少2 min;保证样品和介质充分接触,收集流出液,可以反复上样增加结合效率。
3)用 10-15倍柱体积的 Wash Buffer 进行洗杂,去除非特异性吸附的杂蛋白,收集洗杂液。必要时可以调整咪唑的浓度进行洗杂。
4)使用5-10倍柱体积的 Elution Buffer 洗脱,分段收集,每一个柱体积收集一管,分别检测,既可以保证所有结合的目的蛋白被洗脱,又可以得到高纯度和高浓度的蛋白。
上述步骤介质洗脱结束后,先用Lysis Buffer 冲洗3倍柱体积,然后用纯水冲洗5倍柱体积,再用 20%乙醇冲洗2个柱体积,然后将介质置于2-8℃保存。2.5 SDS-PAGE 检测
将使用纯化产品得到的样品(包括流出组分、洗杂组分和洗脱组分)以及原始样品使用 SDS-PAGE检测纯化效果。
3.在位清洗
当填料使用过程中发现反压过高或者填料上面出现明显的污染时,需要进行在位清洗操作(Cleaning-in-Place,CIP)。
建议按照下面操作去除填料上残留的污染物,如沉淀蛋白、疏水蛋白和脂蛋白等。
去除强疏水结合的蛋白,脂蛋白和脂类
通过使用 30%异丙醇清洗 5-10个柱体积,接触时间为 15-20 min 可以去除此类污染物。然后,再使用 10倍柱体积的去离子水清洗。也可以选择使用含有去污剂的酸性或碱性溶液,清洗填料 2倍柱体积。例如,含有0.1-0.5%非离子去污剂的 0.1 M 醋酸溶液,接触时间为 1-2 小时。去污剂处理后。需要使用70%的乙醇清洗5个柱体积。以彻切底去除去污剂。最后使用10倍柱体积的夫离子水清洗。
去除离子作用结合的蛋白
使用 1.5M NaCI溶液清洗 10-15 min。然后,再使用去离子水清洗 10个柱体积。
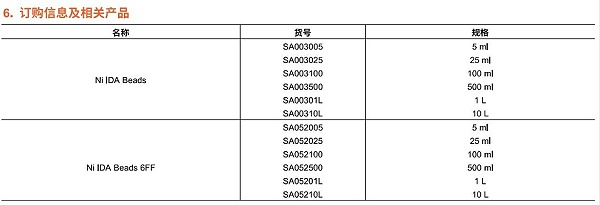
4.填料再生
组氨酸标签蛋白亲和纯化填料所带的镍离子不需要经常螯合去除和重新挂镍离子。当填料使用过程中发现颜色变浅,或者填料载量明显变低时,需要进行对填料进行镍离子剥离和重新挂镍离子,也就是填料再生。将填料装填在合适的层析柱内,按照下面操作流程进行镍离子剥离和重新挂镍离子。
1)使用5倍柱体积去离子水清洗填料;
2)使用5倍柱体积100 mM EDTA(pH 8.0)剥落镍离子;
3)使用10倍柱体积去离子水清洗填料;
4)使用0.5M NaOH清洗5倍柱体积,停留 10-15min;
5)使用去离子水清洗填料,直至 pH中性;
6)使用 3-5倍柱体积 100 mM NiSO4再生挂镍;
7)使用10倍柱体积去离子水清洗;
填料再生后,可以立即使用,如不立即使用,需要将填料悬浮干等体积的 20%乙醇中,置于2-8°℃保存。