

天根DNA纯化试剂盒-DP205产品简介
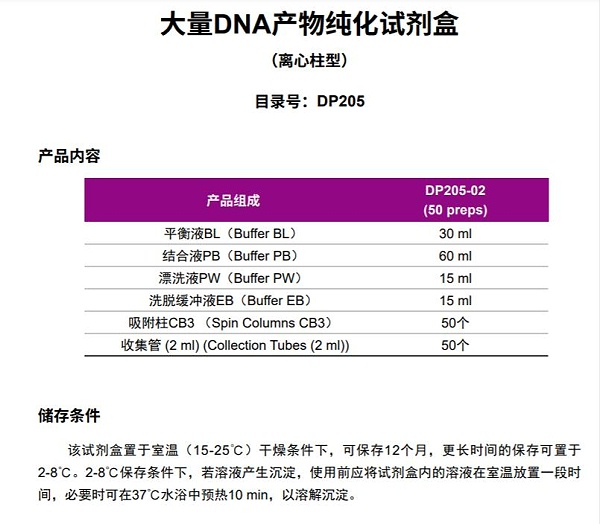
天根DNA纯化试剂盒-DP205试剂盒采用独特的离心吸附柱纯化酶切、PCR等反应溶液中的DNA片段,同时除去蛋 白质、其它有机化合物、无机盐离子及寡核苷酸引物等杂质,回收100 bp-10 kb DNA片段, 回收率可达80%以上。每个离心吸附柱每次可吸附的DNA量为20 μg。 使用本试剂盒回收的DNA可适用于各种常规操作,包括酶切、PCR、测序、文库筛选、 连接和转化等实验。
产品特点 快速:整个操作过程只需十几分钟,节省时间。
多样:可以回收单链、双链DNA片段以及环状质粒DNA。
高效:离心柱和缓冲液可大量回收到高纯度目的DNA。
1.本试剂盒适用于无选择性的回收溶液中所有DNA片段(可去除50 bp以下的小片段),如 需选择性回收特定片段,同时去除其他不同大小片段,请选择胶回收试剂盒。
2.洗脱缓冲液加量应根据回收前DNA量来决定:如回收前DNA只有1-5 μg左右,则应选用 超薄型离心柱,加20-50 μl洗脱缓冲液;回收前为5-20 μg左右的DNA,应选用普通型离 心柱,加30-100 μl洗脱缓冲液;如回收前有20-30 μg左右DNA,则应选用大量型离心 柱,加50-300 μl洗脱缓冲液。
3.回收率与初始DNA量和洗脱体积有关,初始量越少、洗脱体积越少,回收率越低。
4.对于10 kb的DNA片段可以适当的增加吸附和洗脱的时间
5.平衡液BL的加入能够改善吸附柱的吸附能力并提高吸附柱的均一性和稳定性,消除高温 /潮湿或其他不良环境因素对吸附柱造成的影响。使用前请先检查平衡液BL是否出现浑 浊,如有混浊现象,可在37℃水浴中加热几分钟,即可恢复澄清。
6.用平衡液处理过的柱子应当天使用,放置时间过长会影响效果。
注意事项 请务必在使用本试剂盒之前阅读此注意事项
天根DNA纯化试剂盒-DP205操作步骤
使用前请在漂洗液PW中加入无水乙醇,加入体积请参照瓶上的标签。所有离心步骤均为使用台式离心机在室温下离心。
1. 柱平衡步骤:向吸附柱CB3中(吸附柱放入收集管中)加入500 μl的平衡液BL,12,000 rpm (~13,400×g) 离心1 min,倒掉收集管中的废液,将吸附柱重新放回收集管中。(请使用 当天处理过的柱子)
2. 估计PCR反应液或酶切反应液的体积,向其中加入5倍体积的结合液PB,充分混匀(无 需去除石蜡油或矿物油)。 注意:如PCR反应体系为100 μl(不包括石蜡油体积), 则加入500 μl结合液PB。
3. 将上一步所得溶液加入一个吸附柱CB3中(吸附柱放入收集管中),室温放置2 min, 12,000 rpm(~13,400×g)离心30-60 sec,倒掉收集管中的废液,将吸附柱CB3放入收集 管中。 注意:吸附柱容积为800 μl,若样品体积大于800 μl可分批加入。
4. 向吸附柱CB3中加入600 μl漂洗液PW(使用前请先检查是否已加入无水乙醇),12,000 rpm (~13,400×g)离心30-60 sec,倒掉收集管中的废液,将吸附柱CB3放入收集管中。 注意:如果纯化的DNA是用于盐敏感的实验,例如平末端连接实验或直接测序,建议PW 加入后静置2-5 min再离心。
5. 重复操作步骤4。
6. 将离心吸附柱CB3放回收集管中,12,000 rpm(~13,400×g)离心2 min,尽量除去漂洗 液。将吸附柱置于室温放置数分钟,彻底地晾干,以防止残留的漂洗液影响下一步的实 验。 注意:漂洗液中乙醇的残留会影响后续的酶反应(酶切、PCR等)实验
7. 取出吸附柱CB3放入一个干净的离心管中,向吸附膜中间位置悬空滴加适量洗脱缓冲液 EB,室温放置2 min。12,000 rpm(~13,400×g)离心2 min,收集DNA溶液。 注意:洗脱液的体积不应少于50 μl,体积过少会影响回收的效率。洗脱液的pH值对于洗 脱效率有很大影响。若后续做测序,需使用ddH2O做洗脱液,并保证其pH值在7.0-8.5范 围内,pH值低于7.0会降低洗脱效率;且DNA产物应保存在-20℃,以防DNA降解。DNA 也可以用缓冲液(10 mM Tris-Cl, pH8.0) 洗脱。为了提高DNA的回收量,可将离心得到的 溶液重新加回离心吸附柱中,再次离心。