

使用紫外分光光度计进行蛋白质的定量的方法有许多,常用的是紫外线吸收法、BCA 方法、Bradford法、双缩脲方法、 洛瑞 法、WST法等。蛋白质定量方法这5种方法对比如下:
表 1. 蛋白质定量方法的详细信息
|
|
原则
|
浓度
范围
|
优点
|
缺点
|
|
紫外线吸收
|
280 nm 处的最大吸收对应于酪氨酸和色氨酸的响应,用于分析方法。
|
50 至 2000µg/mL (*BSA)
|
简单的方法。样品测量后即可使用。
|
每种蛋白质的吸光度不同。无法测量在 280 nm 处没有吸收的蛋白质,如胶原蛋白和明胶。在紫外区有吸收的核酸污染使测量变得模糊。
|
|
双缩脲
|
多肽链与铜离子螯合后,蛋白质溶液变成紫色。将包含硫酸铜和罗谢尔盐的双缩脲试剂的碱性溶液添加到蛋白质溶液中。使用 540 nm 处的最大吸收来确定数量。
|
150 至 9000 µg/mL (BSA)
|
简单的程序。大多数蛋白质的显色率是恒定的。
|
灵敏度低。无法测量蛋白质浓度低的样品。显色反应受高浓度三氨基甲烷、氨基酸和铵离子的影响。
|
|
洛瑞
|
在蛋白质溶液中加入碱性铜溶液。蛋白质的酪氨酸、色氨酸和半胱氨酸还原苯酚试剂的钼酸和磷钨酸,使溶液变蓝。使用 750 nm 处的最大吸收来确定数量。
|
5 至 200 微克/微升 (BSA)
|
高灵敏度。广泛使用。
|
程序复杂,准备时间长。由于显色反应是通过还原反应发生的,因此还原材料的污染会干扰定量测定。每种蛋白质的显色率不同。
|
|
BCA
|
BCA 方法结合了双缩脲法和二辛可宁酸 (BCA)。BCA 对铜离子具有高灵敏度和选择性。当通过蛋白质的还原作用形成的铜离子与 2 个 BCA 分子反应时,溶液变为紫色。使用 560 nm 处的最大吸收来确定数量。
|
20 至 2000 微克/微升 (BSA)
|
简单的程序。灵敏度高,浓度范围广。
|
硫醇、磷脂和硫酸铵会干扰测量。
|
|
布拉德福德
|
当蛋白质与三苯甲烷蓝颜料之一的考马斯亮蓝 G250 结合时,蛋白质的最大吸收从 465 nm 转移到 600 nm。使用 600 nm 处的最大吸收来确定数量。
|
10 至 2000 克/微升 (BSA)
|
非常简单的操作。几乎不受阻挡材料的影响。
|
每种蛋白质的显色率不同。表面活性剂的污染会干扰显色反应。
|
|
WST
|
用高 pH 值的蛋白质还原 WST-8,使样品变蓝。使用 650 nm 处的最大吸收来确定数量。
|
50 至 5000 µg/mL (BSA)
|
简单的方法。几乎不受表面活性剂的影响。
|
每种蛋白质的显色率不同。
|
*BSA:牛血清白蛋白
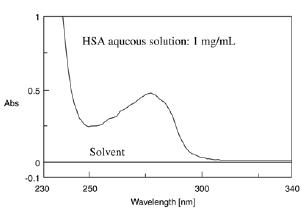
HSA 的吸收光谱
一、紫外分光光度计(比色皿)紫外线吸收法的操作方法:
上图显示了人血清白蛋白 (HSA) 的吸收光谱。简单的紫外吸收分光光度法可以通过使用 280 nm 处的最大吸收来确定样品中蛋白质的数量。
1. 样品准备
|
牛血清白蛋白 (BSA):
|
0.02, 0.025, 0.05, 0.1, 0.2, 0.25, 0.4, 0.5, 1, (1.5, 2) 毫克/毫升
|
|
鸡蛋溶菌酶:
|
0.02, 0.025, 0.05, 0.1, 0.2, 0.25, (0.4, 0.5) 毫克/毫升
|
|
来自牛胰腺的糜蛋白酶:
|
0、0.1、0.2、 0.25 、0.4、0.5 毫克
/ 毫升
|
括号内的值是用于 10 mm 矩形池的浓度。其他值是用于 10 mm 矩形池和微池的浓度。
2. 测量程序及结果
测量蛋白质溶液在 280 nm 处的吸光度。
表 2. 紫外吸收法的结果
|
蛋白质 |
细胞 |
浓度范围 |
校准曲线公式 |
相关函数 |
标准误差 |
检测限 |
测定极限 |
|
牛血清白蛋白 |
10 毫米矩形电池(石英) |
至 2 毫克/毫升 |
Y = AX + B |
0.9994 |
0.0219 |
0.0097 毫克/毫升 |
0.0470 毫克/毫升 |
|
微电池 |
至 1 毫克/毫升 |
Y = AX + B |
0.9999 |
0.002 |
0.0012 毫克/毫升 |
0.0218 毫克/毫升 |
|
|
HEL |
10 毫米矩形电池(石英) |
至 0.5 毫克/毫升 |
Y = AX + B |
0.9991 |
0.0076 |
0.0041 毫克/毫升 |
0.0680 毫克/毫升 |
|
微电池 |
至 0.25 毫克/毫升 |
Y = AX + B |
0.9995 |
0.0031 |
0.0020 毫克/毫升 |
0.0096 毫克/毫升 |
|
|
α-胰凝乳蛋白酶 |
10 毫米矩形电池(石英) |
至 0.5 毫克/毫升 |
Y = AX + B |
0.9997 |
0.0042 |
0.0037 毫克/毫升 |
0.0615 毫克/毫升 |
|
微电池 |
至 0.5 毫克/毫升 |
Y = AX + B |
0.9983 |
0.0104 |
0.0091 毫克/毫升 |
0.1263 毫克/毫升 |
二.紫外分光光度计双缩脲法蛋白质测定
1.添加双缩脲试剂后,蛋白质溶液变为紫色,MAX吸收为 540 nm(图 5)。
2.在 540 nm 吸收处测量显色反应的时间过程。吸光度大约在 60 分钟后变得稳定(图 6)。图 7 显示了 60 分钟后测量的 HSA 水溶液的光谱。双缩脲法通过与样品反应 60 分钟后在 540 nm 处的最大吸收来确定数量。

图 5.添加双缩脲试剂后的颜色变化
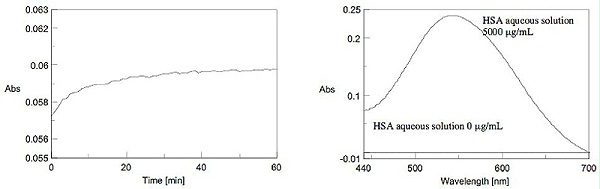
图 6.(左)显色反应的时间过程,图 7.(右)使用双缩脲法的 HSA 溶液光谱
3. 显色试剂准备
双缩脲试剂:在100 mL水溶液中加入60 mL 10% NaOH,溶解0.3 g CuSO4 和1.2 g罗谢尔盐,然后加水定容至总体积200 mL。(标准试剂可存放在聚乙烯瓶中。)
4.样品准备
|
牛血清白蛋白 (BSA):
|
0、0.25、0.5、 1 、5、9 mg/mL(
10 mm 矩形池(石英))
|
|
|
0, 1, 3, 5, 9 mg/mL(微量池)
|
|
鸡蛋溶菌酶:
|
0、1、3、 5 、9 mg/mL(10 mm 矩形池(石英)、微池)
|
|
来自牛胰腺的糜蛋白酶:
|
0、1、3、 5 、9 mg/mL(10 mm 矩形池(石英)、微池)
|
5. 测量程序及结果
将 Biuret 试剂 (2.0 mg) 添加到 500 μL 的蛋白质水溶液中并充分混合。然后使溶液反应 60 分钟。在 540 nm 波长处测量吸光度。
表 3. 双缩脲法的结果
|
蛋白质
|
细胞
|
浓度范围
|
校准曲线公式
|
相关函数
|
标准误差
|
检测限
|
测定极限
|
|
牛血清白蛋白
|
10 毫米矩形电池(石英)
|
至 9 毫克/毫升
|
Y = AX 2 + BX + C |
1
|
0.0109
|
0.008 毫克/毫升
|
0.1483 毫克/毫升
|
|
微电池
|
至 9 毫克/毫升
|
Y = AX 2 + BX + C |
0.9998
|
0.0775
|
0.0696 毫克/毫升
|
1.0127 毫克/毫升
|
|
|
溶菌酶
|
10 毫米矩形电池(石英)
|
至 0.9 毫克/毫升
|
Y = AX 2 + BX + C |
1
|
0.0144
|
0.0133 毫克/毫升
|
0.2420 毫克/毫升
|
|
微电池
|
至 9 毫克/毫升
|
Y = AX 2 + BX + C |
0.9999
|
0.0786
|
0.0640 毫克/毫升
|
--
|
|
|
α-胰凝乳蛋白酶
|
10 毫米矩形电池(石英)
|
至 9 毫克/毫升
|
Y = AX 2 + BX + C |
0.9996
|
0.0958
|
0.0934 毫克/毫升
|
1.2987 毫克/毫升
|
|
微电池
|
至 9 毫克/毫升
|
Y = AX 2 + BX + C |
0.9998
|
0.0697
|
0.0695 毫克/毫升
|
0.9987 毫克/毫升
|

图 8.添加苯酚试剂后的颜色变化
三、 洛瑞法蛋白质测定
当碱性铜溶液和苯酚试剂添加到蛋白质溶液中时,蛋白质溶液变成蓝色,最大吸收为 750 nm(图 8)。在 750 nm 吸收处测量显色反应的时间进程。吸光度在大约 10 分钟后变得稳定。60 分钟(图 9)。图 10 显示了 60 分钟后测量的 HSA 水溶液的光谱。
Lowry 方法通过在样品反应 60 分钟后使用 750 nm 的MAX 吸收来确定数量。
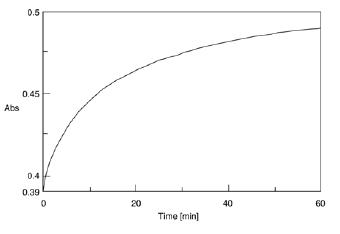
图 9.显色反应的时间过程轨迹
1.试剂准备:碱性铜溶液:将 50 mL 2% Na2CO3 溶液*3)与 1 mL 0.5% CuSO4 溶液 *4) 混合(只能用于即时分析)。
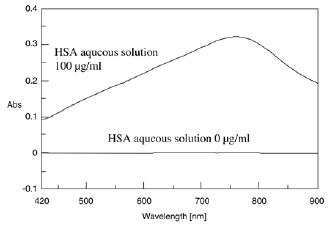
图 10. Lowry 法得到的 HSA 水溶液谱图
苯酚试剂:将市售溶液稀释至1N。
2.样品制备
相同的浓度用于 10 mm 矩形池和 10 mm 微池。
|
牛血清白蛋白 (BSA):
|
0、2、20、
50 、100、200 µg/mL
|
|
鸡蛋溶菌酶:
|
0、1、5、
10 、20、50、100 、 200 µg/mL
|
|
来自牛胰腺的α-胰凝乳蛋白酶:
|
0、2、20、
50 、100、200 µg/mL
|
3.测量程序余结果
在 500 μL 的蛋白质溶液中加入 2.5 mg 碱性铜溶液。充分混合后让其反应 10 分钟。然后,加入苯酚试剂。快速混合并让溶液反应 60 分钟。测量 750 nm 处的吸光度。
表 4. Lowry 方法的结果
|
蛋白质 |
细胞 |
浓度范围 |
校准曲线公式 |
相关函数 |
标准误差 |
检测限 |
测定极限 |
|
牛血清白蛋白 |
10 毫米矩形电池(石英) |
至 200 µg/mL |
Y = AX 2 + BX + C |
0.9999 |
1.2336 |
0.8385 微克/毫升 |
3.9441 微克/毫升 |
|
微电池 |
至 200 µg/mL |
Y = AX 2 + BX + C |
0.9994 |
2.5325 |
2.3903 微克/毫升 |
10.1765 微克/毫升 |
|
|
溶菌酶 |
10 毫米矩形电池(石英) |
至 200 µg/mL |
Y = AX 2 + BX + C |
0.9998 |
1.3861 |
0.7598 微克/毫升 |
3.5722 微克/毫升 |
|
微电池 |
至 200 µg/mL |
Y = AX 2 + BX + C |
0.9997 |
1.6514 |
0.8911 微克/毫升 |
4.1471 微克/毫升 |
|
|
α-胰凝乳蛋白酶 |
10 毫米矩形电池(石英) |
至 200 µg/mL |
Y = AX 2 + BX + C |
1 |
0.685 |
0.4371 微克/毫升 |
7.6764 微克/毫升 |
|
微电池 |
至 200 µg/mL |
Y = AX 2 + BX + C |
0.9999 |
1.3341 |
1.0214 毫克/毫升 |
16.3006 毫克/毫升 |
通过以上实验结果参数对比,可以发现这几种蛋白定量分析方法原理都是基于紫外吸收分光光度法的定量方法,所以可以使用简单的紫外-可见分光光度计进行蛋白质定量分析或进行DNA 、RNA浓度测定的常用方法。苏州阿尔法生物提供的核酸提取仪、紫外分光光度计
、均质机、冷冻离心机、超速离心机等实验室设备,更多内容可0512-62956104 咨询。